アクセサリー細胞
アクセサリーサイボウ
【英】accessory
cell(A cell)
→抗原提示細胞
|
抗原提示細胞
コウゲンテイジサイボウ
【英】antigen
presenting cell(APC)
抗原をリンパ球に提示してリンパ球の活性化を促す細胞でアクセサリー細胞accessory cell(A cell)の一つ.通常,ヘルパーT細胞*
|
ヘルパー T細胞
ヘルパーティーサイボウ
【英】helper T
cell(Th)
T細胞*のサブセットの一つ.活性化されたヘルパーT細胞は細胞間の直接の相互作用あるいは液性因子を産生することにより免疫応答*を増強する.大部分のヘルパーT細胞は細胞表面にCD 4抗原を表現しており,自己の主要組織適合遺伝子複合体*(MHC)のクラスII分子と外来抗原を同時に認識し活性化される.ヘルパーT細胞が産生する因子にはT細胞などの増殖・分化を誘導するIL‐2,造血系幹細胞の増殖を誘導するIL‐3, T細胞,B細胞*の増殖・分化を誘導するIL‐4, IL‐5, BSF‐2/IL‐6などがある.→インターロイキン,リンホカイン
|
に抗原を提示するマクロファージ*
|
キラーT細胞
キラーティーサイボウ
【英】killer T
cell
【独】T‐Killer‐Zelle
【仏】cellule
T cytotoxique
同義語:細胞傷害性T細胞cytotoxic T cell(Tc), cellule T cytotoxique, 細胞傷害性Tリンパ球cytotoxic T lymphocyte(CTL), zytotoxische T‐Zelle, lymphocyte T
cytotoxique
抗原特異的に標的細胞*と結合してこれを破壊するT細胞亜群で,マーカーとしてCD8抗原をもつ.同系の標的細胞に対するキラーT細胞は細胞表面の非自己抗原と共に自己と同一のクラスI主要組織適合抗原を認識して破壊する(MHC拘束)ので,ウイルス感染細胞の除去などに有効である.同種の標的細胞に対するキラーT細胞は移植片拒絶反応の中心的役割を果たす.→K細胞,ナチュラルキラー細胞
|
やSteinmanの樹枝状細胞をさす.これらはクラスII主要組織適合抗原(Ia抗原)を表面にもち,マクロファージの働きで処理された抗原(ペプチド断片)を自己Ia抗原と共にT細胞に提示する.多くはインターロイキン*‐1 interleukin‐1(IL‐1)を放出する.なおキラーT細胞*など他のリンパ球には別の細胞が抗原提示をすることがある.
|
→腹腔滲出細胞
|
腹腔滲出細胞
フククウシンシュツサイボウ
【英】peritoneal
exudate cell(PEC)
ペプトン,流動パラフィン,グリコーゲン,チオグリコール酸などの刺激で動物の腹腔に滲出する炎症細胞inflammatory cellの総称.刺激後早期には好中球が優位であるが,後期に大部分がマクロファージとTリンパ球で占められるようになる.腹腔滲出細胞中のマクロファージはリンパ球の試験管内免疫(抗体)応答を補助するアクセサリー細胞a抗原提示細胞
コウゲンテイジサイボウ
【英】antigen
presenting cell(APC)
抗原をリンパ球に提示してリンパ球の活性化を促す細胞でアクセサリー細胞accessory cell(A cell)の一つ.通常,ヘルパーT細胞*に抗原を提示するマクロファージ*やSteinmanの樹枝状細胞をさす.これらはクラスII主要組織適合抗原(Ia抗原)を表面にもち,マクロファージの働きで処理された抗原(ペプチド断片)を自己Ia抗原と共にT細胞に提示する.多くはインターロイキン*‐1 interleukin‐1(IL‐1)を放出する.なおキラーT細胞*など他のリンパ球には別の細胞が抗原提示をすることがある.ccessory cell(A cell)ないし抗原提示細胞*antigen presenting cell
|
キラーT細胞
キラーティーサイボウ
【英】killer T
cell
【独】T‐Killer‐Zelle
【仏】cellule
T cytotoxique
同義語:細胞傷害性T細胞cytotoxic T cell(Tc), cellule T cytotoxique, 細胞傷害性Tリンパ球cytotoxic T lymphocyte(CTL), zytotoxische T‐Zelle, lymphocyte T
cytotoxique
抗原特異的に標的細胞*と結合してこれを破壊するT細胞亜群で,マーカーとしてCD8抗原をもつ.同系の標的細胞に対するキラーT細胞は細胞表面の非自己抗原と共に自己と同一のクラスI主要組織適合抗原を認識して破壊する(MHC拘束)ので,ウイルス感染細胞の除去などに有効である.同種の標的細胞に対するキラーT細胞は移植片拒絶反応の中心的役割を果たす.→K細胞,ナチュラルキラー細胞
|
となる.しかし,過剰の腹腔滲出細胞はリンパ球応答を逆に抑制する.
|
アクセサリー細胞とは
アクセサリー細胞は、主に免疫応答において他の免疫細胞を補助し,抗原提示を通じてT細胞を活性化する役割を持つ細胞の総称です。
主な種類
- マクロファージ
- 樹状細胞(dendritic cell)
- B細胞
これらはいずれも抗原提示細胞(APC)として知られ,取り込んだ抗原を処理・断片化したうえでMHC分子と結合させ,T細胞に提示します。
役割と機構
- 抗原の取り込み・分解
- MHCクラスII分子への抗原断片の搭載
- 共刺激分子(CD80/CD86など)の発現
- 形成された免疫シナプスを介したT細胞活性化
これにより,ナイーブT細胞が増殖・分化し,特異的な細胞性免疫や体液性免疫が開始されます。
臨床応用・意義
- 抗がん免疫療法:樹状細胞ワクチンやマクロファージ操作による腫瘍抗原提示の強化
- 自己免疫疾患:過剰な共刺激シグナルを抑制することで炎症を緩和
- ワクチン設計:最適なアジュバントと組み合わせ,効率的なT細胞応答を誘導
これらの応用は,アクセサリー細胞の抗原提示能力と共刺激シグナル制御機構を標的にする点で極めて有望です。
まとめ
アクセサリー細胞は,免疫応答の起点として欠かせない存在です。種類ごとの性質や発現する分子マーカー,そしてそれらを操作する方法を理解することで,新たな免疫療法やワクチン開発につなげることができます。
さらに知りたい場合は,以下のトピックもおすすめです。
- プロフェッショナルAPC(樹状細胞)の分子生物学
- クロスプレゼンテーション機構とMHCクラスI提示
- 免疫チェックポイント阻害剤とアクセサリー細胞の相互作用
- 老化や慢性炎症に伴うアクセサリー細胞機能の変化
これらを踏まえて,次のステップや研究アイデアを一緒に掘り下げていきましょう!
Goong.com: “accessory
cell とは 日本語訳と意味”
アクセサリー細胞の種類
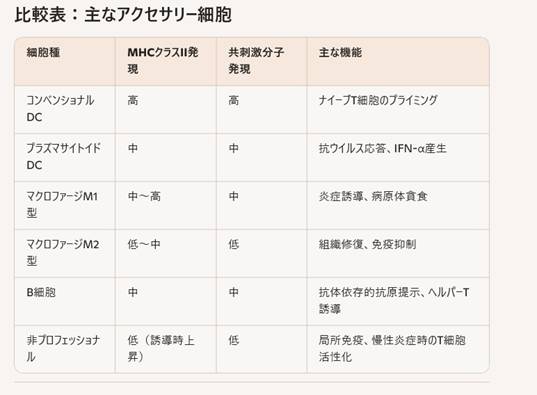
アクセサリー細胞は、主に抗原提示を介してT細胞を活性化し免疫応答を開始・調節する役割を持つ細胞群です。大きく分けて「プロフェッショナルAPC(抗原提示細胞)」と「非プロフェッショナルAPC」に分類されます。
プロフェッショナルAPC(専門的な抗原提示細胞)
これらの細胞は常に高レベルのMHCクラスIIと共刺激分子を発現し、ナイーブT細胞を強力に活性化します。
- 皮膚由来のランゲルハンス細胞や、組織間質のコンベンショナルDC(cDC)、プラズマサイトイドDC(pDC)など多様なサブセットが存在
- 抗原取り込み能が非常に高く、リンパ節へ遊走してT細胞プライミングを行う
- M1型(古典的活性化型)は炎症性サイトカインを産生し、感染部位での抗原提示を担う
- M2型(代替的活性化型)は組織修復や免疫抑制的環境形成に関与
- 抗体産生に加え、特異的抗原をBCRで取り込みMHCクラスIIで提示
- メモリーB細胞は二次応答時に強力なT細胞援助を受ける
非プロフェッショナルAPC
通常は低レベルのMHCクラスIIを保持しますが、炎症シグナル(IFN-γなど)を受けて抗原提示能を獲得することがあります。
- 上皮細胞・内皮細胞
- 線維芽細胞・平滑筋細胞
- 神経膠細胞(例:ミクログリア)
これらは臓器特異的な局所免疫に関与し、持続感染や自己免疫など特殊な状況下でのT細胞活性化を助けます。
樹状細胞サブセット
樹状細胞は主に常在型コンベンショナルDC(cDC)とプラズマサイトイドDC(pDC)に大別され、炎症環境下では単球由来DC(moDC)も誘導されます。
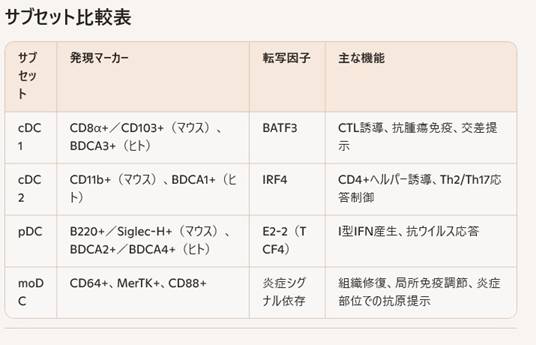
コンベンショナルDC(cDC)
cDCは機能と転写因子の依存性から、cDC1とcDC2の2つのサブセットに分類されます。
- 発現マーカー:マウスではCD8α+またはCD103+、ヒトではBDCA3+(CD141)
- 転写因子:BATF3依存
- 主な機能:MHCクラスI交差提示能が高く、細胞傷害性T細胞(CTL)誘導に優れる
- 発現マーカー:マウスではCD11b+、ヒトではBDCA1+(CD1c)
- 転写因子:IRF4依存
- 主な機能:MHCクラスII経路でのCD4+ヘルパーT細胞誘導、Th2/Th17応答の制御
プラズマサイトイドDC(pDC)
pDCはTLR7およびTLR9を高発現し、I型インターフェロンを大量に産生して抗ウイルス応答を迅速に開始します。T細胞プライミング能はcDCに比べ限定的です。
単球由来DC(moDC)
炎症部位で血中単球が分化して一過的に出現するmoDCは、組織修復や局所免疫調節に寄与します。Ly6CやF4/80を排除した後にCD64、MAR-1、MerTK、CD88などを発現する点が特徴です。
サブセット比較表
さらなる応用展開
- cDC1を標的にしたクロスプレゼンテーション強化ワクチンの設計
- pDCを介するI型インターフェロン療法による抗ウイルス・抗腫瘍免疫増強
- moDCを利用した組織工学的アプローチや炎症緩和療法
次は各サブセットのシングルセルトランスクリプトームプロファイリングや、腫瘍微小環境・粘膜環境における機能変動について掘り下げていきましょう。
シングルセルトランスクリプトームプロファイリングの意義
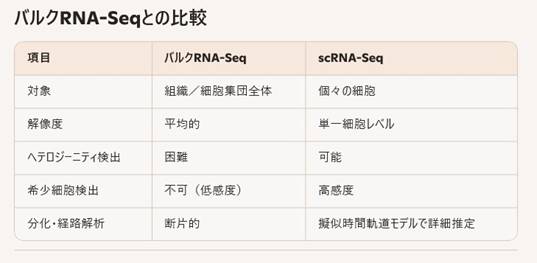
従来のバルクRNA-Seqが組織や細胞集団の平均的な遺伝子発現を解析するのに対し、シングルセルRNAシーケンス(scRNA-Seq)は個々の細胞単位で全転写産物を網羅的に計測し、細胞間の多様性や動的状態を高解像度で明らかにします。
主な意義
- 細胞ヘテロジーニティの解明
単一の組織内に存在する希少細胞群や遷移状態の細胞を同定し、その比率や遺伝子発現パターンを可視化できる。
- 分化・発生経路の推定
疫学的にサンプリングした細胞の遺伝子発現プロファイルを用い、擬似時間解析(pseudotime)で細胞分化の軌跡を推定できる。
- 免疫サブセットや腫瘍微小環境の解析
免疫細胞の細かなサブセット分類や、腫瘍浸潤リンパ球の活性化状態を個別に捉え、免疫応答や腫瘍免疫療法標的の探索に役立つ。
- 疾患メカニズムの細胞レベル解明
慢性炎症やがん組織などの病態部位で、細胞種間相互作用ネットワークや細胞間シグナル伝達の変化を解析し、病因解明やバイオマーカー発見に貢献する。
- 新規細胞マーカー・治療標的の発見
細胞種特異的に発現する遺伝子を同定し、新たな診断マーカーや薬剤標的の探索基盤を提供する。
バルクRNA-Seqとの比較
さらなる展開
- マルチオミクス統合
scRNA-Seqに加え、シングルセルATAC-Seqやプロテオミクスを組み合わせ、遺伝子発現とエピジェネティクスの連動解析を実施。
- 時空間トランスクリプトミクス
細胞の空間的配置情報と発現プロファイルを同時取得し、組織構造と機能の連関を探る。
- 患者由来モデルでの応用
患者腫瘍やiPSC由来細胞モデルにscRNA-Seqを適用し、個別化医療や創薬評価に活用。
こうしたアプローチが、細胞レベルの詳細な生物学的理解と革新的な治療戦略の創出を加速しつつあります。
【参考文献】
- Illumina scRNA-Seqアプリケーションノート
- 仲尾なつ『シングルセル解析の動向と展望』JSBi
Bioinformatics Review
胞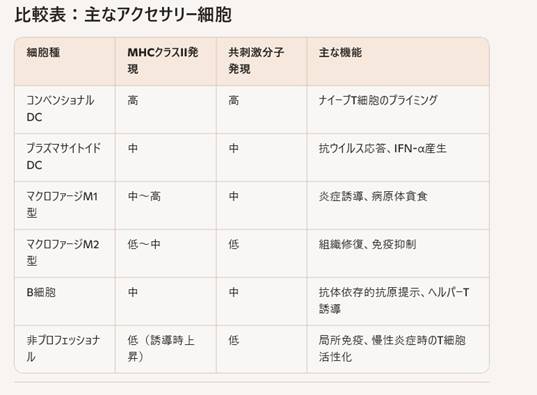
 さらに詳しく掘り下げたい場合は、以下のトピックがおすすめです。
さらに詳しく掘り下げたい場合は、以下のトピックがおすすめです。
- 樹状細胞サブセット(cDC1 vs cDC2)の機能的違い
- マクロファージの極性制御シグナルと抗腫瘍免疫
- B細胞による抗原交差提示メカニズム
- 非プロフェッショナルAPCが関与する慢性炎症・自己免疫病理
これらを踏まえて、研究テーマや臨床応用への展開を一緒に検討していきましょう!
マルチオミクス統合とは
マルチオミクス統合は、ゲノミクス、トランスクリプトミクス、エピゲノミクス、プロテオミクスなど複数のオミクスデータを同時に解析し、生物学的システムを立体的に解明するアプローチです。単一のオミクス層だけでは検出が難しい細胞応答や疾患メカニズムをより深く探ることができます。
マルチオミクス統合の意義
- 細胞間ヘテロジーニティの全貌把握
単一レイヤー解析では見落とされがちな希少サブセットや遷移状態を掘り起こせる。
- 病態メカニズムの立体的理解
遺伝子変異→転写制御→タンパク質発現→エピジェネティクス変化まで因果連鎖を追跡し、疾患ドライバーを特定する基盤となる。
- 新規バイオマーカー・治療標的探索
異なるレベルで発現相関を見ることで、単層解析では検出困難なマルチレイヤーバイオマーカーを同定できる。
主な統合手法
 マルチオミクス解析のワークフロー
マルチオミクス解析のワークフロー
- データ取得・QC
- NGS, プロテオーム解析, エピゲノム解析など各オミクスで品質管理を徹底する
- 正規化・前処理
- クロスプラットフォーム比較を可能にするため、適切な正規化手法を選択。
- 統合アルゴリズム適用
- mixOmicsのDIABLO/MINTやMOFAなど目的に応じた手法を実行。
- モデル検証・可視化
- 潜在変数の抽出、熱マップやサーキット図でマルチレイヤーの相関を可視化
- バイオロジカルインタープリテーション
- 統合結果をもとにパスウェイ解析やネットワーク解析、実験的検証を行う
主なツール・パッケージ
- mixOmics(Rパッケージ)
DIABLO, MINTによる多変量統合解析を提供し、変数選択や潜在構造の可視化に強みを持つ。
- MOFA/MOFA2
ベイズモデルで潜在因子を抽出し、多層データ間の共変動を捉えるフレームワーク。
- MultiAssayExperiment(Bioconductor)
複数オミクスデータセットを一元管理し、統合解析ワークフロー構築を支援するオブジェクト指向パッケージ。
応用例
- がんサブタイプ分類
TCGAデータ(mRNA、miRNA、プロテイン)をDIABLOで統合し、乳がんサブタイプを高精度に同定。
- 抗腫瘍メカニズム解明
ゲノム変異とエピゲノム変化、プロテオーム応答を統合して、薬剤耐性ドライバーを探索。
- 個別化医療への展開
患者由来iPSCやオルガノイドのマルチオミクスプロファイルから最適治療戦略を提示。
今後の展望
- 時空間トランスクリプトミクスやマルチオミクス+イメージングの融合
- AI/深層学習を用いた高次元データ統合と予測モデル強化
- クロス種比較や大規模コホートデータ統合による汎用バイオマーカー開発
これらの進展が、疾患診断や治療戦略の精緻化、さらには生命システムの総合理解を大きく前進させるでしょう。
統合手法の具体的な使用例
マルチオミクス統合において代表的な手法であるDIABLO(N-integration)およびMINT(P-integration)の具体的な活用事例を紹介します。
1. DIABLOによるTCGA乳がんデータ統合解析
- RパッケージmixOmicsのDIABLOフレームワークを用い、「breast.TCGA」データセットを読み込み
- 訓練データ150サンプル、検証データ70サンプルに分割
- レイヤー:mRNA、miRNA、プロテオーム の3種類
- Basal, Her2, LumAの乳がんサブタイプを識別するための潜在変数を抽出し、
それぞれのオミクスから最も特徴的なバイオマーカー候補を選定
- 結果の可視化は散布図やサークルプロットで行い、オミクス間相関パターンを明示的に把握
2. MINTによる異なるコホート間データ統合
- 同一の分子(例:遺伝子発現)を測定した複数の独立コホートから取得したRNA-Seqデータを統合
- P-integration手法であるMINTを適用し、コホートごとのバッチ効果をモデル内で補正
- 各コホートから共通して観測される生物学的シグナルを抽出
- 抽出された共通潜在変数から、複数コホートにわたるバイオマーカーの頑健性評価や、新規治療標的の同定に利用
3. シングルセルマルチオミクス統合の事例紹介
- Illumina社の専門家事例では、シングルセルレベルのゲノム・トランスクリプトーム・エピゲノムデータを統合
- データの可視化と統合アルゴリズムを組み合わせ、細胞間シグナル伝達ネットワークを再構築
- 特にバッチノイズの除去や統合後のクラスタリング精度向上に成功
これらの事例は、マルチオミクス統合手法を実際のデータセットへ適用する際の基本的な流れとポイントを示しています。次のステップとしては、
- 様々なアルゴリズム(MOFA, JIVEなど)との比較検討
- 統合後のパスウェイ解析やネットワーク解析への展開
- 患者コホートやiPSC由来モデルへの応用
などに取り組むことで、新たなバイオマーカー発見や個別化医療開発へとつなげることが期待されます。




 さらに詳しく掘り下げたい場合は、以下のトピックがおすすめです。
さらに詳しく掘り下げたい場合は、以下のトピックがおすすめです。 マルチオミクス解析のワークフロー
マルチオミクス解析のワークフロー