アクチン
アクチン
【英】actin
【独】Aktin
【仏】actine
筋原線維*myofibril
|
筋原線維
キンゲンセンイ
【英】myofibril
【独】Myofibrille
【仏】myofibrille
【ラ】myofibrilla
骨格筋*
|
骨格筋
コッカクキン
【英】skeletal
muscles
【独】Skelettmuskeln
【仏】muscle
squelettique
【ラ】musculus
skeleti
同義語:横紋筋striated
muscle
筋組織は骨格筋,平滑筋,心筋の3種に分けられるが,骨格筋は能動運動器として身体の運動を司る.人体には約400の骨格筋があり,体重の約50%を占める.筋の主要成分は水(75%),タンパク質(20%)その他少量のグリコゲンなどを含む.付着部位により骨格筋,皮筋,関節筋を区別する.付着のうち収縮時に移動する方を停止insertio,固定している方を起始origoという.筋の起始・停止は強い結合〔組〕織*
|
骨格筋
コッカクキン
【英】skeletal
muscles
【独】Skelettmuskeln
【仏】muscle
squelettique
【ラ】musculus
skeleti
同義語:横紋筋striated
muscle
筋組織は骨格筋,平滑筋,心筋の3種に分けられるが,骨格筋は能動運動器として身体の運動を司る.人体には約400の骨格筋があり,体重の約50%を占める.筋の主要成分は水(75%),タンパク質(20%)その他少量のグリコゲンなどを含む.付着部位により骨格筋,皮筋,関節筋を区別する.付着のうち収縮時に移動する方を停止insertio,固定している方を起始origoという.筋の起始・停止は強い結合〔組〕織*
|
結合〔組〕織
ケツゴウソシキ
【英】connective tissue
【独】Bindegewebe
【仏】tissu conjonctif
結合〔組〕織は中胚葉由来の組織で種々の臓器の構造および代謝の維持を行う働きがある.基本的には通常の線維性結合〔組〕織 fibrous connective tissueにみられるように,線維芽細胞*とこの細胞の産生した細胞間物質(細胞間質*)よりなっている.細胞間物質としては膠原線維*,弾性線維*,細網線維 reticular fiberなどの線維と酸性粘液多糖類を主とする基質がある.骨や軟骨も基本的には線維性結合〔組〕織とおなじ構造であるが,細胞間物質の量がきわめて多い.脂肪細胞や白血球も結合〔組〕織の成分とされている.
|
からなる腱tendoまたは腱膜aponeurosisをなす.紡錘状筋において起始に近い部を筋頭caput,停止に近い部を筋尾cauda,中部を筋腹venterという.骨格筋線維(筋細胞)は紡錘形をした多核細胞で,数mmから15cmの長さを持ち,太さも20~200 μmの大型細胞である.筋の血管はよく発達し筋線維をとりまいて豊富な毛細管網を作る.筋線維の収縮は脳・脊髄の運動細胞から起こる運動神経線維が個々の筋線維に達しその表面に運動終板を作って興奮を伝える.
|
からなる腱tendoまたは腱膜aponeurosisをなす.紡錘状筋において起始に近い部を筋頭caput,停止に近い部を筋尾cauda,中部を筋腹venterという.骨格筋線維(筋細胞)は紡錘形をした多核細胞で,数mmから15cmの長さを持ち,太さも20~200 μmの大型細胞である.筋の血管はよく発達し筋線維をとりまいて豊富な毛細管網を作る.筋線維の収縮は脳・脊髄の運動細胞から起こる運動神経線維が個々の筋線維に達しその表面に運動終板を作って興奮を伝える.
|
や心筋の筋細胞(筋線維)を縦走する約1μm径の細線維で,いくつかの群をなして走行するため,筋細胞の横断面ではコーンハイム野Cohnheim's fieldと呼ばれる斑紋がみられる.生の筋細胞を偏光顕微鏡でみると筋原線維は複屈折性で暗調なA帯A band(anisotropic
band)と,単屈折性で明調なI帯I band(isotropic band)との交互の縞としてみられ,これらの縞が各筋原線維で位相をそろえて配列しているので筋細胞の横紋cross striationとしてみえる.横紋はヘマトキシリン・エオジン染色*標本で,A帯は濃染され,I帯は淡染されることで明瞭に観察される.さらに,I帯の中央には濃染のZ線Z lineがみられ,Z線から次のZ線までを筋節sarcomereといい,筋原線維の構造的単位と考えられている.電子顕微鏡で筋原線維のサブユニットとして5~7nm径のアクチン細糸actin
filamentと10~20nm径のミオシン細糸myosin filamentとの2種の筋細糸myofilamentがみられ,これらの筋細糸は規則正しく平行に配列しており,筋収縮はこれら2種の細糸の滑りによって生じると考えられている(細糸すべり説).筋原線維は筋小胞体sarcoplasmic
reticulumの網目によって包まれており,各線維間には多数のミトコンドリア*
|
ミトコンドリア
ミトコンドリア
【英】mitochondria
【独】Mitochondrien
【仏】mitochondrie
【ラ】mitochondrion
同義語:糸粒体
細胞質内に存在する球形ないし棒状形の小体であり,旺盛に酸素を消費しながらATPを合成する役をになうために「細胞の呼吸装置」とも称される.糸粒体は自身の限界膜である外糸粒体膜,これに10~20nmの細隙をへだてて対向する内糸粒体膜(この膜内に電子伝達系と酸化的リン酸化系の諸酵素が組み込まれる),および糸粒体基質(クエン酸回路*の酵素群がここに存在)からなる.内糸粒体膜の一部分が基質に向かいヒダ状または盲端管状に伸び出したものがクリスタcristaである.基質内に直径30~50nmの顆粒が少数存在するが,これはCa2+,Mg2+などを含有し基質のイオン組成調節にあずかるとされる.糸粒体はDNA*と各種RNA*をそなえ,自己増殖能とタンパク合成能を示すことから,一つの生物体とみなすことができる.糸粒体は大きさや形の上でも細菌に似ており,細胞質内に寄生したある種の細菌がそのまま細胞内小器官として定着したものにほかならないとの見方がある.
|
が列をなして存在している.
|
の細いフィラメントの主成分であるばかりでなく,あらゆる細胞の細胞骨格cytoskeletonの構成成分であり,細胞の分裂,形態変化,運動などに関与している多機能タンパク質である.単量体(GアクチンG actin)は分子量42,000,375個前後のアミノ酸からなり,その一次構造は動物種間や組織間で大きな差はない.X線解析によると,アクチン分子は非対称的な2個のドメイン*
|
ドメイン
ドメイン
【英】domain
同義語:〔Ig〕分子内領域
生体高分子の構造上または機能上の単位を表す領域をいう.構造領域とも呼ばれる.免疫グロブリンはドメイン構造をもつ代表的なタンパク分子で,抗体活性基を構成する可変領域からなるVL, VHドメイン,補体成分ならびにFc受容体との結合部位を含む定常領域を構成するCL, CHドメインがあり,CHドメインは免疫グロブリンのクラスに固有の一次構造をもち,さらにCH 1,CH 2,CH 3に分かれる.μ鎖とε鎖にはCH 4ドメインが加わる.
|
からなり,ドメイン間の大きな裂け目にATP(アデノシン三リン酸*)
|
アデノシン三リン酸
アデノシンサンリンサン
【英】adenosine
triphosphate(ATP)
【独】Adenosintriphosphat
【仏】ade´nosine triphosphate
アデニンヌクレオチドのうち,リン酸を3個結合したもの.5′‐アデノシン三リン酸は分子内に2個の高エネルギーリン酸結合をもち,生合成,能動輸送,筋収縮,生物発光など多彩なエネルギー要求反応に用いられる.解糖系や発酵などの嫌気的代謝によっても生成するが,ミトコンドリアにおける酸化的リン酸化反応により効率よく生産される.RNAや補酵素の構成成分となるほか,種々のリン酸化反応のリン酸供与体ともなり,アデニル酸シクラーゼ*
|
アデニル酸シクラーゼ
アデニルサンシクラーゼ
【英】adenylate
cyclase
同義語:アデニリルシクラーゼ,アデニルシクラーゼadenyl〔yl〕 cyclase
EC
4.6.1.1. ATP ┻ cAMP+PPiの反応を触媒する酵素*.
|
酵素
コウソ
【英】enzyme,
ferment
【独】Enzym,
Ferment
【仏】enzyme,
ferment
生体内における化学反応を触媒するタンパク質で,生体細胞内で合成される.一般に熱に不安定であり,60℃以上では変性,失活する.物質代謝など生体内の多種,多様の反応は,個々の反応にそれぞれ固有の酵素によって触媒される.したがって反応が起こり得るかどうかは,その反応を触媒する酵素を生物が合成し得るかどうかに依存しており,酵素の種類と性質が生物種の特性を決めると考えられる.酵素反応は基質が酵素に結合することによって進行し,酵素は基質の構造に対してきわめて厳密な特異性(基質特異性substrate specificity)を示すのが普通である(例えば光学異性体を識別する).酵素表面の触媒作用に直接関与する部位を活性中心*といい,タンパク質の構造のみからできている場合と,触媒作用に不可欠な補酵素*coenzyme,補欠分子族*,金属などの配合族を含む構造から成る場合がある.配合族を除いた酵素(アポ酵素*)は酵素活性を示さない.酵素が機能する際には特定の条件(温度,pHなど)を必要とし,また種々の物質によって酵素活性が増大(賦活化)したり減少(阻害)したりすることもある.国際生化学連合酵素委員会は,触媒する反応の様式によって酵素を次の6群に分類している. 1)酸化還元酵素oxidoreductase(オキシドレダクターゼ*), 2)転移酵素transferase(トランスフェラーゼ*), 3)加水分解酵素hydrolase(ヒドロラーゼ), 4)除去付加酵素lyase(リアーゼ*), 5)異性化酵素isomerase(イソメラーゼ*), 6)合成酵素synthase(シンターゼ;→リガーゼ).これらは基質の性質,作用様式などによってさらに細かく分類される.→酵素反応
|
広く生物界に分布する.動物組織では細胞膜に結合し,活性中心を細胞内に向けて存在する.その活性はGTP結合タンパク質(Gタンパク〔質〕*)の制御を受ける.種々のペプチドホルモン,神経伝達物質,その他の生理活性物質が細胞膜の特異的受容体に結合するとその刺激がGTP結合タンパク質に伝わり,このタンパク質が次にアデニル酸シクラーゼと相互作用することによりこの酵素の活性を調節する.その結果,細胞内のcAMPの濃度が変動する.cAMPは細胞内二次メッセンジャーとして,細胞の代謝機能の調節をする.
|
によってcAMP(サイクリックAMP*)をも生ずる.
|
が結合する.Gアクチンは生理的イオン強度下でATPの加水分解を伴って重合体(FアクチンF actin)となる.Fアクチンは方向性をもつ二重らせんで,半ピッチ36nmに13個の単量体を含む.筋肉ではほとんどすべてのアクチンは重合し,トロポミオシンtropomyosinやトロポニンtroponinとともに筋原線維の細いフィラメントを形成し,ミオシンフィラメントと相互作用して収縮を引き起こす(→アクトミオシンactomyosin).
|
アクトミオシン
アクトミオシン
【英】actomyosin
【独】Aktomyosin
【仏】actomyosine
アクチン*とミオシン*の複合体で,筋収縮*の試験管内モデルとして用いられる.FアクチンF actinとミオシンを混合すると矢尻構造をもつ複合体が形成される.生理的塩濃度では微細なゲル状粒子として懸濁しているが,Mg‐ATPを添加すると超沈殿を起こす.その際のATPase(アクトミオシンATPase)活性はミオシン単独の場合に比べ数十倍も高い.適当な条件を用いるとアクトミオシンファイバーactomyosin fiberを作製することも可能であり,これはMg‐ATPによって収縮し,張力測定も可能である.アクトミオシンATPaseはCa2+制御を受けないが,トロポミオシン‐トロポニン複合体を加えるとCa2+感受性が生じ,筋肉から0.6 MKClで長時間抽出して得られる“天然アクトミオシン”に相当する複合体が再構成される.アクトミオシンの三次元電子顕微鏡像に,X線解析から得られたアクチンおよびミオシン頭部の分子構造を重ね合わせることによって,複合体の分子モデルが作製されている.
|
非筋細胞ではアクチンは最も含量の多いタンパク質で全タンパク質の5~10%を占める.そのうち,約半分が重合し大小さまざまなフィラメントを形成している.これらは種々のタンパク質と結合して,ミクロフィラメントに代表される“アクチン含有線維”として種々の役割をもつ.細胞内にはアクチンの重合・脱重合を制御する種々のタンパク質(アクチン調節タンパク質actin‐binding protein)が存在しており,多種多様なフィラメントを必要に応じて形成したり消失させたりする.このことによってアクチンは多機能性を発揮すると考えられている.
Actin
定義
アクチンは真核生物の細胞内で最も豊富に存在するタンパク質の一つで、細胞骨格を構成し、形状維持や細胞運動に中心的な役割を果たす。
構造と重合動態
G-アクチンとF-アクチン
- G-アクチン(globular actin)は約42 kDaの単量体。
- ATPまたはADPと結合し、重合可能な準備状態にある。
- F-アクチン(filamentous actin)はG-アクチンが右巻き二重らせん構造として重合したマイクロフィラメントで、直径6–7
nm、長さ無数に伸びる。
ATP/ADP依存的重合
- ATP結合G-アクチンはプラス端への付加速度が速く、マイナス端からの脱重合速度が遅い。
- ADP結合G-アクチンはその逆で、プラス端付加は遅く、マイナス端からの脱重合が促進される。
- 臨界濃度はプラス端で約0.1 µM、マイナス端で約0.6 µM。これにより細胞内での“テッドリーミング”現象が生じる。
重合の調節因子
- Arp2/3複合体:新しい分岐を作る核生成タンパク質
- フィロポディン(profilin):ATP–G-アクチンのプラス端付加を促進
- コフィリン(cofilin):ADP–F-アクチンを分解
- トロポミオシン(tropomyosin):ストレスファイバーの安定化
これらはいずれも細胞シグナルに応答して時空間的に構造変化を誘導する。
細胞内での主な役割
- 形状維持と機械的支持
- 細胞運動(ラメリポディア、フィロポディア形成)
- 細胞分裂時の収縮環形成(サイトカインシス)
- 筋肉収縮:ミオシンと相互作用し、サルコメア単位で収縮を起こす
- エンドサイトーシスやエキソサイトーシスの駆動
これらの機能はATP加水分解に伴うアクチン重合・脱重合サイクルがエネルギー源となっている。
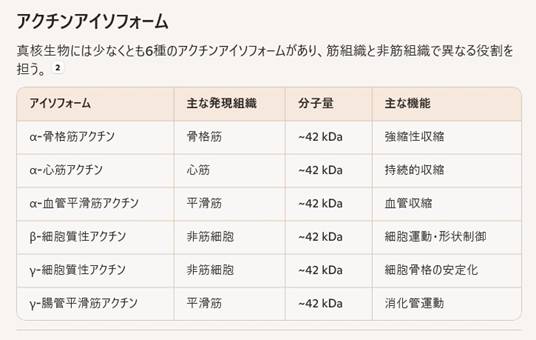
アクチンアイソフォーム
真核生物には少なくとも6種のアクチンアイソフォームがあり、筋組織と非筋組織で異なる役割を担う。
細胞動態の可視化・応用
- 蛍光フィロイジン標識:F-アクチンを可視化
- 電子顕微鏡/クライオEM:高分解能構造解析
- AFM(原子間力顕微鏡):リアルタイムでの配列変化観察
- 細胞内シミュレーション(ABMなど):アクチン・ミオシン相互作用や運動メカニズムをモデル化
これらの手法により、アクチン細胞骨格の動的再構築が時空間的に捉えられつつある。
臨床・研究上の意義
- ファロイジン:F-アクチンを固定化し、蛍光標識に応用
- シトカラシン:プラス端キャップ、運動抑制・薬理研究に使用
- 神経疾患やがん細胞の運動機構解明の標的
- 細胞接着や機械的受容(メカノセンサー)としての役割も注目
アクチン機能の異常は細胞移動障害、筋ジストロフィー、がん転移など多岐にわたる疾患機構に関与する。
次に知りたいことや応用例
- アクチン–ミオシン系の力学モデル
- 細胞運動シミュレーション(ABM)
- アクチンネットワークの力学的計測(トラジェクトリー解析など)
- 疾患モデル(筋ジストロフィー、がん転移)の分子シミュレーション
これらのトピックは細胞骨格の多機能性をさらに深く理解し、創薬やバイオエンジニアリングへの応用につながります。
アクチン異常による主な疾患
1. ACTN2変異による
Core Myopathy
- ACTN2(α-アクチニン2)のホモ接合性変異が骨格筋内に「コア」(ミオフィブリルの局所的な変性)を形成し、筋力低下や運動耐容能の低下を引き起こすことが報告されています。
2. ACTB変異に関連する症候群
- Baraitser-Winter症候群1型(BRWS1)
- 難聴ジストロフィー様症候群1型(DDS1)
- 血小板減少症8型(THC8)
- 皮膚細胞モザイク症
これらはすべて ACTB(β-細胞質性アクチン)遺伝子の変異が原因となる発達異常や血液凝固障害など、多彩な表現型を示します。
3. その他のアクチン異常に伴う疾患

ACTA1(α-骨格筋アクチン)や
ACTG1(γ-細胞質性アクチン)の変異でも、ネマリンミオパチーや遺伝性難聴などの疾患が知られています。これらのアイソフォームごとの表現型や診断・治療戦略についてさらに深く知りたい場合はお知らせください。
アクチン異常によって引き起こされる主な疾患
以下では、アクチンやアクチン遺伝子の異常が関与する代表的な疾患をまとめます。最初に大分類を示し、その後で各疾患の概要を解説します。
大分類リスト
- 心血管疾患
- 先天性ミオパチー
- 発達障害・神経疾患
- 血小板減少症
- 感染症への易感性
1. 心血管疾患
- 心筋収縮ユニットの構造不安定化が、心不全や不整脈のリスクを高める
2. 先天性ミオパチー
- 筋繊維内フィラメント構造の異常が筋力低下を引き起こす
3. 発達障害・神経疾患
- Baraitser-Winter症候群1型(BRWS1)
- 難聴ジストニア症候群(DDS1)
4. 血小板減少症
- β-アクチン(ACTB)変異による血小板減少症8型(THC8)
- 血小板形成や機能異常による出血傾向を示す
5. 感染症への易感性
- 細胞内侵入を仲介するアクチンフィラメント動態の乱れが原因
- ウイルスや細菌のエンドサイトーシス・遊走に影響し、感染リスクの増大を招く
以上のように、アクチンは細胞骨格として多彩な組織・器官で必須機能を担うため、その異常は筋肉、心臓、血液、神経、免疫など幅広い疾患に直結します。
さらに知っておきたい関連情報
- 遺伝子検査によるACTA1/ACTC1/ACTB/ACTG1のスクリーニング法
- アクチン動態可視化のための蛍光ライブイメージング技術
- アクチン‐ミオシン相互作用を標的とした治療薬の開発動向
- 細胞モデル/動物モデルを用いた機構解析プロトコル
- 近年注目のアクチン結合タンパク質(Arp2/3、フォルミン、コフィリンなど)調節による疾患制御戦略
これらを踏まえ、疾患の早期診断から新規治療法開発に向けた研究が世界各地で活発に進められています。 first
アクチン異常の具体的な症例
以下に、文献で報告されている代表的な“アクチン細胞骨格異常”の症例を2例示します。
症例1:Alzheimer病大脳皮質神経細胞におけるアクチン骨格異常
- 患者背景:70代後半のアルツハイマー病(AD)既往者
- 検体・手法:自発死後採取した大脳皮質切片を高速凍結割面観察および免疫染色(drebrin抗体)で解析
- 主な所見:drebrin発現の著明な低下と、アクチンフィラメント束の分散・乱れが認められ、神経細胞のシナプス構造破綻と相関することを示唆
症例2:Baraitser-Winter cerebrofrontofacial syndrome(BWCFF)に伴うACTB変異例
- 患者背景:口唇口蓋裂や前頭葉形成異常を伴う先天性顔面脳発達障害
- 遺伝学的解析:ACTB遺伝子の病的バリアント(例:p.Gly146Asp)が同定
- 細胞モデル:患者由来培養線維芽細胞において、アクチン分子が上皮細胞膜近傍に集積せず、細胞間接着や形態形成に異常を来すことを実証
これら以外にも、
- ACTA1変異によるネマリンミオパチー(筋細胞内にネマリン小体形成、重度筋力低下)
- ACTC1変異による肥大型/拡張型心筋症(心筋収縮ユニットの不安定化)
といった具体的な臨床報告があります。
ご希望があれば、これら他疾患の臨床経過や遺伝子変異情報を詳しくまとめてご紹介できます。
アクチン異常の治療法
アクチン異常に伴う疾患の治療は、基本的に「発症メカニズムに応じた対症療法」と「分子レベルでの新規アプローチ」に大別できます。
1. 対症療法
- 心筋症(ACTC1変異)
- 標準的心不全治療:β遮断薬、ACE阻害薬/ARB、ミネラルコルチコイド受容体拮抗薬
- デバイス療法:ペースメーカー、植込み型除細動器(ICD)
- 重症例では心移植を検討
- 先天性ミオパチー(ACTA1変異)
- 理学療法・作業療法:筋力維持と関節可動域の維持
- 呼吸管理:呼吸筋低下例で非侵襲的換気療法
- 栄養管理:誤嚥予防とエネルギー摂取の最適化
- 発達障害・神経疾患(ACTB変異など)
- 形成外科的対応:口蓋裂・顔面奇形への修復術
- リハビリテーション:言語療法、理学療法、作業療法
- 教育的支援:発達障害に応じた特別支援プログラム
- 血小板減少症
- 血小板輸血:重篤な出血時の緊急対応
- トロンボポエチン受容体作動薬(エルトロンボパグなど)
2. 分子標的・新規治療戦略
- フォルミン阻害剤(例:SMIFH2)
- Rho-ROCKシグナル阻害剤
- アクチン結合タンパク質(Arp2/3、コフィリン等)を標的としたモノクローナル抗体開発
- ウイルスベクターやナノ粒子を用いたmRNA導入、アンチセンスオリゴ(ASO)
- CRISPR/Cas9による遺伝子修復
- 患者由来筋芽細胞やiPS細胞を用いた筋再生アプローチ
3. 臨床応用に向けた研究展望
- ハイスループット薬剤スクリーニング:疾患モデル細胞でアクチン調節薬を網羅的に探索
- 患者由来iPS細胞・オルガノイドモデル:アクチンネットワーク病態の再現と創薬評価
- オプトジェネティクス/光化学制御:空間的・時間的にアクチン重合を制御し、生体内応答を解析
これらのアプローチは現在、基礎研究〜前臨床研究の段階にありますが、数年以内の臨床試験開始が期待されています。アクチン骨格は全身の多様な組織で機能するため、疾患サブタイプごとの特異的な分子標的薬開発がカギとなっています。
今後はエビデンスを積み重ねつつ、患者さん個々の遺伝子変異や細胞モデルに基づく“オーダーメイド治療”への展開が進むでしょう。
遺伝子治療の具体的な方法
遺伝子治療は大きく分けて体内(in vivo)と体外(ex vivo)のアプローチがあり、それぞれ特徴的な技術と手順を持ちます。
1. in vivo 遺伝子置換療法
- ベクター選択
- アデノ随伴ウイルス(AAV)やレンチウイルスなどを運搬体として利用
- 組織特異的プロモーター(筋肉ならMHCK7、心臓ならcTnTなど)を組み込むことで標的組織へ発現誘導
- 投与経路
- 全身投与:血管内注射で全身筋肉や心筋への遺伝子導入を狙う
- 局所投与:神経や網膜へは髄腔内注入/硝子体内注入などを用いる
- 代表的成功例
- Luxturna(RPE65遺伝子補充、網膜色素変性)
- Zolgensma(SMN1遺伝子補充、脊髄性筋萎縮症)
2. ex vivo 細胞修飾療法
- 患者細胞の採取
- 遺伝子導入&選抜
- ウイルスベクターや電気穿孔法で目的遺伝子を導入
- 発現を確認した細胞を拡大・品質評価
- 患者への移植
- 適用例
- CAR-T療法(がん免疫細胞のex vivo遺伝子改変)
3. 遺伝子編集技術
- gRNAとCas9タンパク質を一緒に投与し、特異的な塩基切断を誘導
- HDR(相同組換え)を利用して正しい配列を補修
4. 核酸医薬(ASO・siRNA)
- スプライシング修正やmRNA分解によって異常タンパク発現を抑制
- 例:Spinraza(SMAのASO治療)
- RISC複合体を介して標的mRNAを分解し、変異蛋白の発現を抑える
5. 合成mRNA療法
- LNP(脂質ナノ粒子)で修飾mRNAを包接
- 細胞内で一過性に正常蛋白を発現させる
- ワクチン技術応用で開発が加速中
関連トピック
- ACTA1変異ミオパチー向けAAV筋肉特異的遺伝子補充の前臨床モデル
- iPS細胞を用いたex vivo ACTB変異修復後の分化能評価
- in vivoベクターの免疫反応低減に向けたキャプシド改変技術
- 光応答型CRISPRシステムによる時空間制御編集
これらを組み合わせ、「個々の変異プロファイルに最適化したオーダーメイド遺伝子治療」の実現が期待されています。
アクチン異常研究の最新動向
アクチン異常を解明し、治療に結びつけるための研究は多岐にわたっています。特に2025年以降注目されているテーマを以下に整理しました。
1. ナノスケール構造の動的再構築解析
- 神経軸索に存在する周期的膜骨格(MPS)の構造と機能を、凍結割面観察や超高解像度顕微鏡で可視化。
- 細胞内Ca²⁺シグナルがスペクトリン‐アクチン構造をリモデルし、神経活動や疾患進行に与える影響を定量的に評価。
2. 分子レベルでの動態制御メカニズム解明
- アクチン重合フィラメントに対する毒素/阻害剤(サイトカラシンDなど)の作用を、TIRF顕微鏡によるリアルタイム観察で解析。
- フィラメントの“キャッピング”や“切断”を制御する新たな分子メカニズムが明らかになり、創薬標的として注目。
3. 細胞内局所合成とコンパートメント制御
- 細胞質内の特定領域でのアクチンmRNA局所翻訳を、高感度mRNAイメージングと単一粒子追跡で追跡。
- 局所的なアクチン濃度調節が細胞形態形成やシナプス可塑性に与える影響を、モデル系で再現・定量化。
4. 遺伝子・細胞治療技術の応用
- AAVベクターを用いたin vivo遺伝子補充や、ex vivoでのCRISPR/Cas9編集によるACTA1・ACTC1変異修復。
- ベース編集/プライム編集によるオフターゲット低減、iPS細胞を介した筋細胞移植アプローチなど、オーダーメイド治療パイプラインの構築。
まとめと展望
今後は上記技術を組み合わせ、
- 患者由来オルガノイドやiPS細胞モデルでの疾患再現性向上
- 組織特異的プロモーター制御による標的精度の強化
- 光操作型CRISPRなどによる時空間制御編集
といった方向性が加速していきます。これらの研究成果は、アクチン異常に起因する心筋症・ミオパチー・神経疾患への新たな治療標的発見・創薬へとつながることが期待されています。


