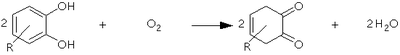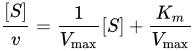酵素-5(な)
|
に 乳酸ラセマーゼ
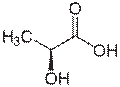
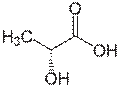
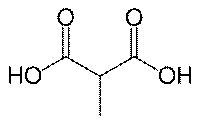
乳酸ラセマーゼ(lactate racemase)は、乳酸の2つの立体異性体の間の相互変換を触媒する酵素である。 (S)-乳酸
分布乳酸菌のうちLactobacillus sakei、Lactobacillus curvatus、Lactobacillus plantarumなど数種で知られている。また乳酸菌以外でもクロストリジウム(嫌気性真正細菌)や特定の好塩古細菌などで活性が示されている[1]。なお乳酸ラセマーゼをコードするlarA遺伝子自体は広範な原核生物から見出されている[2]。 構造と性質酸化に強い感受性があるため生化学的研究はほとんど行われていない[1]。1968年にL. sakeiの乳酸ラセマーゼを用いた研究があり、分子量およそ25kDaで鉄イオンの関与が示唆されていた[3]。一方2014年になってL. plantarumの乳酸ラセマーゼの遺伝子larAが同定されたが、それによれば分子量はおよそ46kDaで活性にニッケルを要求する[2]。 反応機構C. beijerinckiiでは、酵素のスルフヒドリル基にα-カルボニル中間体が共有結合する機構で酵素が働くという証拠が得られている[4]。 L. sakeiから精製した乳酸ラセマーゼは乳酸脱水素酵素活性は示さない[3]。またこの酵素は、AMP、オキサミン酸、アタブリン、アデノシン一硫酸塩、シアニド、そしていくつかの鉄キレート剤で阻害されることが分かっている。この酵素で触媒される化学反応は、D型とL型の存在量が等モルになった点で平衡に達する[3]。 L. plantarumでは、最初にL-乳酸が生成され、乳酸ラセマーゼの活性を誘導する。乳酸ラセマーゼはL-乳酸の不存在下では発現しない。酵素の活性が誘導されると、D-乳酸が生成されるようになり[1]、最終的にほぼ等量のD-乳酸とL-乳酸が生成し、平衡に達する。この種では、lar活性は、D-乳酸によって抑制され、larオペロン活性はL-乳酸によって正の制御を受ける。つまり、larオペロン活性は、L-乳酸/D-乳酸比によって制御されることになる。 重要性L. plantarumにおけるピルビン酸の乳酸への代謝には、2つの経路が存在する。その1つはNAD依存性乳酸脱水素酵素によりD-乳酸を生成するもので、もう1つは乳酸ラセマーゼによるものである。乳酸脱水素酵素が不活化または阻害された場合、乳酸ラセマーゼは細菌のD-乳酸生成の救出経路として働く[1]。L. plantarumにおけるD-乳酸生成は、細胞壁の生合成と関係しているため、この働きは重要である。実際に、乳酸脱水素酵素を欠き、L-乳酸のみを生成するlarオペロンを持つ変異体では、ペプチドグリカン生合成が起こらなかった。 出典
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ぬ ヌクレアーゼ ヌクレアーゼ(Nuclease)は核酸分解酵素の総称。デオキシリボ核酸ないしリボ核酸の糖とリン酸の間のホスホジエステル結合を加水分解してヌクレオチドとする。 RNAを分解するリボヌクレアーゼとDNAを分解するデオキシリボヌクレアーゼに分類できる他、両方を分解することができるヌクレアーゼも知られており、その役割も様々である。ウイルスが有するヌクレアーゼには宿主の核酸を分解して自らの核酸の原料とする役割をもつものがある。また、制限酵素もヌクレアーゼの一種であり、これは外来の核酸を分解してウイルスの感染、増殖を防ぐ役割があると考えられている。核酸がメチル化されているとヌクレアーゼは働かなくなるため、自分の核酸を無闇に分解しないようにこの酵素を有する細菌も多い。多細胞生物においては死滅した細胞の核酸を分解するためにヌクレーゼが生産されることがあるほか、特殊な例としては紫外線などの影響で二量化したチミジンをとりはずすためのヌクレアーゼが存在する。 分解の型式により、エンドヌクレアーゼとエキソヌクレアーゼという分類もできる。 エンドヌクレアーゼ(英:endonuclease) 核酸配列の内部(endo-)で核酸を切断する酵素で、すなわち糸を途中で切るように核酸を切断する。制限酵素は代表的なエンドヌクレアーゼである。 エキソヌクレアーゼ(英:exonuclease) 核酸配列の外側(exo-)から、すなわち核酸の5'端または3'端から削るように分解する。DNAポリメラーゼにもエキソヌクレアーゼ活性があるが、それはDNA複製中のミスを校正するためであると考えられている。 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ね ネオプルラナーゼ
検索 ネオプルラナーゼ(Neopullulanase、EC 3.2.1.135)は、プルランに作用しパノース(6-α-D-グルコシルマルトース)を遊離する化学反応を触媒する加水分解酵素である[1]。 系統名はプルラン 4-D-グルカノヒドロラーゼ(パノース形成)(pullulan 4-D-glucanohydrolase (panose-forming))。
概要 2 関連項目 3 出典 4 外部リンク
概要 1988年に、Bacillus stearothermophilus TRS40の生産するプルラン分解酵素が、プルランのα-1,4グルコシド結合を加水分解し、α-パノースを生成することが見いだされた[1]。この酵素の基質特異性はTVAと同じであったが、TVAと比べて澱粉の加水分解力が小さかったことから、ネオプルラナーゼと命名された。この酵素もTVAと同様に、α-1,4結合の他にもα-1,6結合をも加水分解できること、糖転移できることが明らかとされた[2]。
関連項目[編集] プルラナーゼ(EC 3.2.1.41) イソプルラナーゼ(EC 3.2.1.57) 加水分解酵素 出典 ^ a b Imanaka, T. and Kuriki, T. (1989). “Pattern of action of Bacillus stearothermophilus neopullulanase on pullulan”. J. Bacteriol. 171: 369-374. PMID 2914851. ^ 『澱粉の科学と技術』 ISBN 978-4990528706 外部リンク Neopullulanase - MeSH、米国国立医学図書館、生命科学用語シソーラス (英語サイト) カテゴリ: EC 3.2.1酵素加水分解酵素 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ひ PI3キナーゼPI3キナーゼ(英: Phosphoinositide 3-kinase, PI3K、EC 2.7.1.137)は、イノシトールリン脂質のイノシトール環3位のヒドロキシル基(-OH基)のリン酸化を行う酵素である[1]。イノシトールリン脂質は真核生物の細胞膜を構成する成分の一つであり、PI3Kをはじめとしたキナーゼ(リン酸化酵素)の触媒作用を受けてホスファチジルイノシトール3,4,5-三リン酸 PtdIns(3,4,5)P3となり、プロテインキナーゼB(PKB)/Aktを活性化を起こす。このシグナル伝達経路はPI3キナーゼ-Akt経路と呼ばれ、様々な生理作用の発現に関与する。特にインスリンの分泌促進に深く関与することから[2]、新たな糖尿病薬の開発が示唆されている[3]。 分類PI3キナーゼは構造によりクラスI・クラスIIおよびクラスIIIの3つのクラスに分類される。 クラスI
クラスI PI3Kはヘテロ二量体であり、シグナル伝達において重要な役割を果たす。これらはアミノ酸配列の相同性からクラスIAとクラスIBにさらに分けられる。クラスIAは p110α、β およびδからなり、調節サブユニットであるp85α、p55α、p50α、p85βおよびp55γと結合している。これらの調節サブユニットのうちp85αの発現が最も高い。p85α、p55α、p50αは同一遺伝子(Pik3r1)のスプライシングバリアントであり、p85βとp55γはそれぞれPik3r2およびPik3r3遺伝子に由来する。クラスIAはPKBの活性化に関与している。一方、クラスIB PI3Kであるp110γは哺乳類においてのみ発現が見られ、Gタンパク質のβγサブユニットやp101によってその機能を調節される。クラスIBのPI3キナーゼは主にGタンパク質共役受容体(GPCR)からの刺激により活性化され、PtdIns(3,4)P2のリン酸化により産生されたPtdIns(3,4,5)P3は細胞内情報伝達機構においてセカンドメッセンジャーとして機能する。 クラスII・クラスIIクラスIIにはα、βおよびγの4つが存在するが、いずれも調節サブユニットを有さず単量体で酵素活性を示す。クラスIと比較してPtdInsとPtdIns(4)Pに対する基質特異性が高い。クラスIIの機能や活性化機構についてはまだ議論の余地がある。 また、クラスIII PI3KはPtdInsからPtdIns(3)Pを産生し機能的にはクラスIIに近いが、構造的にはクラスIにより類似しておりヘテロ二量体を形成して機能する。クラスIII PI3Kはタンパク質輸送などに関与している。 活性化経路細胞に何らかの刺激が入るとTyr-X-X-Met(YXXM、X=任意のアミノ酸)モチーフを有する分子に対して調節サブユニットであるp85がSH2ドメインを介して結合する。調節サブユニットは2つのプロリンに富んだ領域(PRMモチーフ)を有しており、p110との結合に関与している[4]。活性化したPI3Kは細胞膜においてPtdIns(3,4,5)P3を産生する反応に関与するが、PKBを活性化する経路にはPtdIns(3,4,5)P3がPKBを活性化する直接的な経路と間接的経路が存在する。間接的経路においてはPtdIns(3,4,5)P3がPDK1(3-phosphoinositide-dependent protein kinase-1)と呼ばれるプロテインキナーゼをリクルートし、PKBのリン酸化を行う。さらにPDK2によるPKBのカルボキシル基側末端側ドメインのリン酸化も行われ、PKBは細胞膜から遊離する。 機能PI3Kの機能はイノシトールリン脂質をリン酸化することにより、3位がリン酸化されたホスファチジルイノシトールを生成する反応を触媒することである。この反応による生成物としてPtdIns(3)P、PtdIns(3,4)P2、PtdIns(3,5)2、PtdIns(3,4,5)P3が挙げられる。PI3Kの活性化はその下流にある分子を介して細胞分化・増殖や代謝、細胞遊走、細胞骨格の再構築など多様な生物活性を引き起こすことが知られている。インスリン受容体により活性化されたPI3Kは特に細胞へのグルコースの取り込みやタンパク質およびグリコーゲンの合成に関与している。PtdIns(3,4,5)P3をはじめとしたPI3K産物はPKBやプロテインキナーゼδ1などのプレクストリン相同ドメイン(PHドメイン)、PXドメイン、FYVEドメインなどの配列を持つタンパク質に対して結合し下流にシグナルを伝えることが知られる[5][6]。p110αおよびβは全ての細胞において発現しており、遺伝子工学的な手法によりこれらの遺伝子を欠失させたマウス(ノックアウト(KO)マウス)は胎生致死となることが報告されている[7][8]。p110γは好中球やマクロファージの遊走[9][10]や肥満細胞の脱顆粒反応[11]に関与している。癌細胞においてはクラスIAのp110αに変異が生じていることがあり、酵素活性の上昇が見られる。PTENはPtdIns(3,4,5)P3を脱リン酸化する酵素であり、PI3Kの機能に対して拮抗的に働くことにより抗癌化作用を示す。また、p110δは主に白血球などの免疫系細胞において発現がみられる。 阻害薬
PI3K阻害薬としてワートマニン(Wortmannin)やLY294002などの薬物が存在するが高濃度で生体に投与した際に種々の毒性を発現することが知られている。近年では新規PI3K阻害薬であるAS605240やZSTK474、PI3Kδ特異的阻害薬であるIC486068やIC87114は毒性が少ないことから治療薬としての応用が検討されている。 出典
参考文献1. ^ Vanhaesebroeck B, Leevers SJ, Ahmadi K, Timms J, Katso R, Driscoll PC, Woscholski R, Parker PJ and Waterfield MD.(2001)"Synthesis and function of 3-phosphorylated inositol lipids."Annu.Rev.Biochem. 70,535-602. PMID 11395417 2. ^ Kaneko, Kazuma; Ueki, Kohjiro; Takahashi, Noriko; Hashimoto, Shinji; Okamoto, Masayuki; Awazawa, Motoharu; Okazaki, Yukiko; Ohsugi, Mitsuru; Inabe, Kazunori; Umehara, Toshihiro; Yoshida, Masashi; Kakei, Masafumi; Kitamura, Tadahiro; Luo, Ji; Kulkarni, Rohit N.; Kahn, C. Ronald; Kasai, Haruo; Cantley, Lewis C.; Kadowaki, Takashi (2010-12-01) "Class IA Phosphatidylinositol 3-Kinase in Pancreatic β Cells Controls Insulin Secretion by Multiple Mechanisms" Cell Metabolism 12(6):619-632, doi:10.1016/j.cmet.2010.11.005 3. ^ 日本放送協会、2010年12月6日「糖尿病関わるたんぱく質特定 」『NHKニュース』2010年12月6日参照 4. ^ Otsu M, Hiles I, Gout I, Fry MJ, Ruiz-Larrea F, Panayotou G, Thompson A, Dhand R, Hsuan J, Totty N, et al.(1991)"Characterization of two 85 kd proteins that associate with receptor tyrosine kinases, middle-T/pp60c-src complexes, and PI3-kinase."Cell. 65, 91-104. PMID 1707345 5. ^ Stephens L, Anderson K, Stokoe D, Erdjument-Bromage H, Painter GF, Holmes AB, Gaffney PR, Reese CB, McCormick F, Tempst P, Coadwell J and Hawkins PT.(1998)"Protein kinase B kinases that mediate phosphatidylinositol 3,4,5-trisphosphate-dependent activation of protein kinase B."Science., 279, 710-14. PMID 9445477 6. ^ Anderson KE, Coadwell J, Stephens LR and Hawkins PT.(1998)"Translocation of PDK-1 to the plasma membrane is important in allowing PDK-1 to activate protein kinase B."Curr.Biol. 8,684-91. PMID 9637919 7. ^ Bi L, Okabe I, Bernard DJ, Wynshaw-Boris A and Nussbaum RL.(1999)"Proliferative defect and embryonic lethality in mice homozygous for a deletion in the p110alpha subunit of phosphoinositide 3-kinase."J.Biol.Chem. 274,10963-8. PMID 10196176 8. ^ Bi L, Okabe I, Bernard DJ and Nussbaum RL.(2002)"Early embryonic lethality in mice deficient in the p110beta catalytic subunit of PI 3-kinase."Mamm.Genome. 13,169-72. PMID 11919689 9. ^ Sasaki T, Irie-Sasaki J, Jones RG, Oliveira-dos-Santos AJ, Stanford WL, Bolon B, Wakeham A, Itie A, Bouchard D, Kozieradzki I, Joza N, Mak TW, Ohashi PS, Suzuki A and Penninger JM.(2000)"Function of PI3Kgamma in thymocyte development, T cell activation, and neutrophil migration."Science. 287,1040-6. PMID 10669416 10. ^ Del Prete A, Vermi W, Dander E, Otero K, Barberis L, Luini W, Bernasconi S, Sironi M, Santoro A, Garlanda C, Facchetti F, Wymann MP, Vecchi A, Hirsch E, Mantovani A and Sozzani S.(2004)"Defective dendritic cell migration and activation of adaptive immunity in PI3Kgamma-deficient mice."EMBO J. 23,3505-15. PMID 15318168 11. ^ Laffargue M, Calvez R, Finan P, Trifilieff A, Barbier M, Altruda F, Hirsch E and Wymann MP.(2002)"Phosphoinositide 3-kinase gamma is an essential amplifier of mast cell function."Immunity. 16,441-51. PMID 11911828 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ヒアルロニダーゼ この記事は検証可能な参考文献や出典が全く示されていないか、不十分です。 出典を追加して記事の信頼性向上にご協力ください。(2016年6月)
ヒツジ由来のヒアルロニダーゼ ヒアルロニダーゼ (Hyaluronidase) は、ヒアルロン酸を分解する酵素である。EC番号は3.2.1.35、CAS登録番号は488712-31-8。 ヒアルロン酸を加水分解することによって粘度が低下するが、ヒアルロン酸は間質組織の主成分であるため、組織の浸透性が増加する。そのため、体内での分散を容易にする目的で薬に混ぜて服用されることがある。特に、眼科の手術で局所麻酔とともによく用いられる。また、皮下注入による非経口的液体の吸収率や尿路造影のための放射線不透過性を増加させる目的でも用いられる。さらに、高張液を管外遊出させる目的で用いられることもある。 黄色ブドウ球菌や化膿レンサ球菌、ウェルシュ菌などのある種の細菌も、組織内での運動性を増加させるためや抗原偽装のため、ヒアルロニダーゼを産生する。 多くの哺乳類の受精では、ヒアルロニダーゼは精子が卵細胞に到達した時に先体から放出され、透明帯を消化して中に侵入することを可能にする。 商業用の動物由来のヒアルロニダーゼとしては、Vitrase (ISTA Pharmaceuticals)、Amphadase (Amphastar Pharmaceuticals)、Wydaseなどが販売されている。2005年12月2日に、アメリカ食品医薬品局はヒト由来の組み換えヒアルロニダーゼであるHylenexを認可した。 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
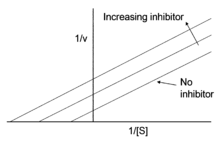
非競合阻害非競合阻害(ひきょうごうそがい、英: non-competitive inhibition)、非拮抗阻害、非競争阻害は、阻害剤が酵素の活性を減少させ、酵素に基質が結合しているかいないかにかかわらず同じようによく結合する酵素阻害機構の一種である[1]。 基質が結合しているかいないかにかかわらず阻害剤が酵素に結合できるが、一方の状態に対して他方より高い親和性を示す場合は、混合型阻害剤と呼ばれる[1]。 用語全ての非競合阻害剤は酵素のアロステリック部位(すなわち活性部位以外の場所)に結合するが、アロステリック部位へ結合する全ての阻害剤が非競合阻害剤ではないことを注記しておくことが大切である[1][2]。実際、アロステリック阻害剤は競合、非競合、不競合阻害剤として作用しうる[1]。 多くの文献はこれら2つの用語を一緒にしたり[3][4]、アロステリック阻害の定義を非競合阻害の定義として記し続けている。 機構
非競合阻害は、どんなときでも阻害剤ならびに基質が共に酵素に結合できる系のモデルを作る。基質と阻害剤の両方が結合する時、酵素-基質-阻害剤複合体は生成物を作ることができず、酵素-基質複合体あるいは酵素-阻害剤複合体に戻ることだけができる。非競合阻害は一般的な混合型阻害とは阻害剤が酵素と酵素-基質複合体に対して等しい親和性を有する点で区別される。 非競合阻害の最もよく見られる機構は、阻害剤のアロステリック部位への可逆的結合を含むが、活性部位への直接的結合を含むその他の方法によって阻害剤が作用することが可能である。競合阻害とは、阻害剤の結合が基質の結合を妨げず(逆もまた同様)、一定時間単純に生成物形成を妨げる点で異なっている。 この種の阻害は、基質に対する触媒の見かけの結合親和性(Kmapp – ミカエリス・メンテン式を参照)を変化させることなく、化学反応の最大速度を減少させる。 式非競合阻害剤の存在下、酵素の見かけの親和性は実際の親和性と等しい。ミカエリス・メンテン反応速度論の観点からは、Kmapp = Kmである。これはルシャトリエの原理の結果と見ることができる。阻害剤は酵素と酵素-基質複合体のどちらにも等しく結合できるため、平衡が維持される。しかしながら、一部の酵素は基質の生成物への変換を常に阻害されているため、酵素の有効濃度は低下する。 数学的には以下の通りである。 例: CYP2C9酵素の非競合阻害剤CYP2C9酵素の非競合阻害剤にはニフェジピン、トラニルシプロミン、フェネチルイソチオシアネート、6-ヒドロキシフラボンがある。コンピュータによるドッキングシミュレーションやアミノ酸置換変異体を用いた実験から、6-ヒドロキシフラボンの非競合結合部位は、CYP2C9酵素の報告されているアロステリック結合部位であることが示されている[5]。 脚注
参考文献
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
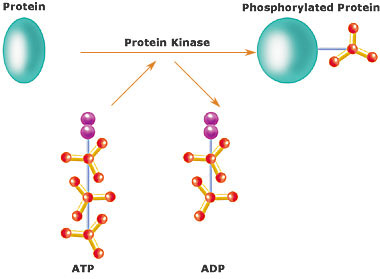
プロテインキナーゼプロテインキナーゼ (Protein kinase; プロテインカイネース) は、タンパク質分子にリン酸基を付加する(リン酸化する)酵素である。タンパク質キナーゼあるいは英語風にプロテインカイネースとも呼ぶ。キナーゼ(リン酸基転移酵素)の中でタンパク質をリン酸化するキナーゼをプロテインキナーゼと呼ぶが、このプロテインキナーゼのことを特にキナーゼと呼ぶことが多い(本記事では以後単にキナーゼという)。 概要細胞は、その機能を維持するため、細胞内のタンパク質をリン酸化、脱リン酸化する反応を繰り返している。このリン酸化によってタンパク質は酵素活性、細胞内での局在や他のタンパク質との会合状態を変化させる。細胞内の30%ものタンパク質がキナーゼによる変化を受け、細胞内における様々なシグナル伝達や代謝の調節因子として機能している。キナーゼ遺伝子はヒトゲノム中に約500種類があり、また真核生物の全遺伝子の約2%を占める。 キナーゼは、ATPのリン酸基をアミノ酸残基にあるヒドロキシ基に移動させ、共有結合させる活性を有する。キナーゼはアミノ酸のうち、主にセリン、スレオニン、チロシン残基をリン酸化させるが、キナーゼがリン酸化するアミノ酸の99%以上はセリン、スレオニンである(セリン/スレオニンキナーゼ)。しかし、0.1%に満たないチロシンのリン酸化(チロシンキナーゼ)の方が生物学的に重要なケースが多い。これら3種類すべてに反応するものや、またこのほかに微生物や植物ではヒスチジンのイミダゾール環窒素原子に反応するもの(ヒスチジンキナーゼ;EC 2.7.13に含まれる)もある。 キナーゼの活性は精密に調節されており、キナーゼ自身もリン酸化によってオン・オフ調節を受ける。これは他のキナーゼのみならず、自分自身によって行われることもあり、“自己リン酸化”という。これらの調節は他の活性化(または抑制)タンパク質や低分子化合物の結合、細胞内での局在変化などによって起きる。 キナーゼの機能異常は病気の原因になることも多い。特にがんに関して詳細な研究が行われており、キナーゼはがん細胞の増殖、移動、浸潤やアポトーシス(細胞死)の調節に関与する。特定のキナーゼを阻害することによって治療に役立てる薬物が開発されており、中にはゲフィチニブ(イレッサ®)やイマチニブ(グリベック®)のように、すでに臨床的に用いられているものもある。 セリン/スレオニンキナーゼセリン/スレオニンキナーゼ(Ser/Thr kinase; 読み:セリン/スレオニン カイネース、EC 2.7.11.*)はセリンまたはスレオニンのヒドロキシ基をリン酸化する。これらは によって調節される。これらのキナーゼの特異性は特定のアミノ酸配列に基づくものではなく、リン酸化される基質はキーとなる数個のアミノ酸(疎水結合やイオン結合による)でキナーゼと結合するから、普通、キナーゼはある性質を共有する「基質ファミリー」全体に対して特異的である。ほとんどのキナーゼは、本当の基質のようにキナーゼに結合するがリン酸化を受けるアミノ酸を欠くような「擬似基質」によって阻害される。擬似基質が取り除かれるとキナーゼは機能を取り戻す。これらのキナーゼの触媒部位は高度に保存されている。 セリン/スレオニンキナーゼには以前は一部を除いて独自のEC番号はなく、"EC 2.7.1.37"を用いていた。国際生化学分子生物学連合IUBMBの命名委員会(NC-IUBMB)によって見直しされ、2005年にそれぞれ独自のEC番号が割り当てられた。 ホスホリラーゼキナーゼホスホリラーゼキナーゼ(EC 2.7.11.19)は初めて発見された(1959年、エドヴィン・クレープスら)セリン/スレオニンキナーゼである。グリコーゲンホスホリラーゼ(グリコーゲンを加リン酸分解する酵素)を活性化する。 プロテインキナーゼAプロテインキナーゼA(AキナーゼまたはPKA、EC 2.7.11.11)は2つのドメインからなり、小ドメインはβシートを、大ドメインはαヘリックスを含む。基質とATPの結合部位は2つのドメインの間隙にある。ATPと基質が結合すると、2つのドメインは互いに回転するように動き、ATPの末端リン酸基と基質のターゲットアミノ酸が近寄って反応が起きやすい位置となる。 制御Aキナーゼは細胞内でcAMPによる調節を受け、グリコーゲン、糖、脂質の代謝の調節など、いくつかの機能を有する。cAMPがないときは4量体(調節サブユニット2個と触媒サブユニット2個:R2C2)からなり、調節サブユニットが触媒サブユニットの活性中心を封鎖している。cAMPが調節サブユニットに結合すると、2個のRCに解離し、これが活性を有する。また触媒サブユニット自体もリン酸化によって調節される。Aキナーゼは次のようなフィードバック機構によってダウンレギュレーションされる:Aキナーゼによって活性化される基質の1つにホスホジエステラーゼがあり、これはcAMPをAMPに変換し、cAMP量を下げてAキナーゼの活性を低下させる。グリコーゲンの分解においては、Aキナーゼがホスホリラーゼキナーゼをリン酸化して活性化し、さらにこれがグリコーゲンホスホリラーゼをリン酸化して活性化するのである。 プロテインキナーゼC概要
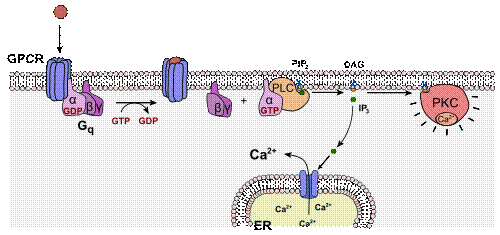
プロテインキナーゼC(プロテインキナーゼ・シー)あるいはPKC、Cキナーゼ (EC 2.7.11.13) は少なくとも10種類以上のアイソザイムから構成されるタンパク質ファミリーである。PKCは基質に存在するセリンおよびスレオニン残基のヒドロキシル基をリン酸化する。1977年に西塚泰美らによって発見された。PKCは、その構造、活性化機構、生理機能によって、在来型(conventionalあるいはclassical:α、βI、βII、γ)、新型(novel:δ、ε、η、θ)、非典型(atypical:ζ、λ/ι)の3つのサブファミリーに分類される。在来型PKCは主にカルシウムイオン(Ca2+)、ジアシルグリセロール (DAG, DG)、あるいはホスファチジルセリン (PS) などのリン脂質によって活性化される。新型PKCはカルシウムイオン結合活性を失っており、ジアシルグリセロールによる活性化を受ける。ジアシルグリセロールは細胞膜、核膜の構成成分であるホスファチジルイノシトール (PI) からホスホリパーゼCによって産生されるため、在来型・新型PKCはシグナル伝達経路においてホスホリパーゼCの下流に位置する。一方、非典型PKCはカルシムイオンおよびジアシルグリセロール結合活性を持たない。在来型PKCの1種であるCαを日本では特にCキナーゼと呼ぶことがある。 アイソザイム
構造と制御在来型PKCは、N末端側の調節領域とC末端側の触媒領域からなる。通常、PKCは調節領域に存在する偽基質領域による自己阻害作用のため不活性化状態で細胞質に存在し、セカンドメッセンジャー(カルシウムやジアシルグリセロール)によって活性化されると、細胞質に移行し基質をリン酸化する。 在来型PKCの調節領域には、連続した2つのC1ドメイン(ジアシルグリセロール結合ドメイン:C1AおよびC1B)とC2ドメイン(カルシウムイオン結合ドメイン)が存在する。新型PKCは、在来型と同様に連続した2つのC1ドメインを有しているが、在来型PKCのC2ドメインとホモロジーを有するC2 likeドメインはカルシウムイオンを結合しない。非典型PKCは1つのC1ドメインのみを有するが、ジアシアルグリセロール結合活性は失なわれている。すべてのPKCアイソザイムの触媒領域はATP結合ドメインとキナーゼドメインからなる。 例として、在来型PKCに共通する一次構造を示す: H2N – 偽基質領域 – C1A - C1B - C2ドメイン – ATP結合ドメイン (C3) – キナーゼドメイン (C4) - COOH 機能PKCのターゲット配列はAキナーゼのものに似ており、リン酸化を受けるセリン/スレオニン残基の近くに塩基性アミノ酸がある。基質にはMARCKS(Myristoylated alanine-rich C kinase substrate)タンパク質、MAPキナーゼ、転写因子阻害タンパク質であるIκB、ビタミンD3受容体(VDR)、Rafキナーゼ、カルパインや上皮成長因子受容体 (EGFR) があり、細胞内シグナル伝達において特に中心的な役割を担っていると考えられる。また、12-O-テトラデカノイルホルボール 13-アセタート (TPA) などの発がんプロモーターや抗がん剤として臨床試験が行われているブリオスタチン類の主要なターゲットとしても知られている。 PKCはがんやアルツハイマー病など様々な疾患に関与していることも明らかになっている。 Ca2+/カルモジュリン依存性タンパク質キナーゼEC 2.7.11.17。カルモジュリン(CaM)キナーゼとも呼ばれ、主にCa2+/カルモジュリン複合体により活性化される。活性化に関して「記憶作用」、つまり活性化反応が終わっても活性化状態が長続きする性質がある。次の2つのタイプがある:
構造と自己調節CaMキナーゼはN末端側の触媒ドメイン、調節ドメイン、および付随ドメインからなる。Ca2+/カルモジュリンがない場合には触媒ドメインは調節ドメイン(基質に似た配列を含む)による自己抑制を受けている。CaMキナーゼはいくつかの分子が会合してホモオリゴマーまたはヘテロオリゴマーになっている。Ca2+/カルモジュリンによって活性化されると、CaMキナーゼ分子は互いにリン酸化しあう。これには2つの効果がある:
MAPキナーゼ
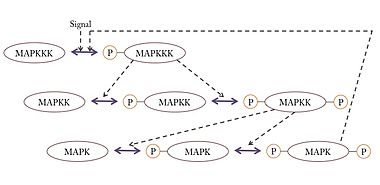
Mitogen-activated protein kinases(マイトジェン活性化プロテインキナーゼ、分裂促進因子活性化タンパク質キナーゼ;EC 2.7.11.24)の略。細胞をマイトジェン(細胞増殖促進物質の総称)で処理した場合に活性化したことからこの名がついた。MAPKKKK => MAPKKK => MAPKK => MAPK (これは一般的な表記法でそれぞれKはキナーゼを意味するが、実際には色々な種類がある)というカスケードを形成して順次活性化され、最終的に転写因子をリン酸化して細胞周期や増殖を制御する。 Mos/RafキナーゼRafはGTP結合型(活性型)のRas(がん遺伝子産物)をはじめとする低分子型GTP結合タンパク質やCキナーゼなどによって活性化され、下流のMEKキナーゼをリン酸化して活性化する。Mosは動物卵の減数分裂で特異的に発現し、その活性(下流のMEK-MAPK-p90Rskを含む)は減数分裂の進行及び減数第二分裂での分裂停止(ヒトデ等の無脊椎動物は減数分裂直後のG1期停止)に必須とされる。これらのキナーゼ自体も元来、原がん遺伝子(c-mos、c-raf)産物として同定されたものである。 cdc2細胞周期の分裂期の制御因子として、分裂酵母、カエル、ヒトデなどいくつかの真核生物から独立に発見された。(2001年のノーベル生理学・医学賞の受賞対象となった研究である。)制御の仕方は生物により異なるが、いずれもサイクリンとよばれるタンパク質と結合することや、それ自身がリン酸化されることによって活性を持ち、特定の基質をリン酸化することで分裂期の特徴的な現象(核膜崩壊、染色体凝集、紡錘体の形成など)を制御する。 チロシンキナーゼチロシンキナーゼ(あるいは蛋白質チロシンキナーゼ、Protein Tyrosine Kinase; PTK、EC 2.7.10.*)はタンパク質のチロシン残基を特異的にリン酸化する酵素である。多細胞生物のみに存在し、細胞の分化,増殖、接着、あるいは免疫反応などに関わるシグナル伝達に関与する。増殖因子が結合することによって活性化する受容体型と、増殖因子が結合しない非受容体型の2型に大別される。チロシンキナーゼが活性化されると、受容体自身、あるいは標的とするタンパクを特異的にリン酸化する。受容体自身の自己リン酸化により、このリン酸化部位を認識するさまざまなシグナル伝達因子が受容体に結合し、シグナル伝達が始まる。また標的タンパクのリン酸化により、細胞内のさまざまなタンパクが次々と活性化し、シグナル伝達が始まる。がんやアテローマ性動脈硬化症、乾癬などでは、過剰に活性化していることがある。 ヒトのチロシンキナーゼは100種類以上あると予想されている[1]が、その大半は機能が分かっていない。 受容体型チロシンキナーゼ細胞膜を膜貫する構造であり、細胞外に増殖因子の結合部位をもち、細胞質領域にチロシンキナーゼ活性部位をもつ。EC 2.7.10.1。増殖因子は哺乳動物では50種類以上が知られ、受容体型チロシンキナーゼは、この増殖因子の刺激を細胞内へのシグナルに変換し、細胞の分裂、分化、形態形成で重要な役割を演ずる。代表的なものを以下に挙げる。
構造受容体型チロシンキナーゼは、3つの領域からなる。増殖因子が結合する細胞外領域、細胞膜を貫通する疎水性膜貫領域、チロシンキナーゼ活性をもつ細胞内領域である。さらに細胞内領域は膜近傍領域、キナーゼ活性領域、C末端領域の3つに分けられる。インスリン受容体やインスリン様増殖因子のように、細胞外領域が分離独立し、ジスルフィド結合で受容体本体に結合する構造をとるものもある。膜貫領域は単一のαヘリックスからなる。 増殖因子が細胞外領域にある受容体に結合すると、受容体は活性化して細胞膜上を移動し、他の受容体に結合して二量体を形成する。同じ受容体同士が結合する(ホモダイマー)ことも、異なる受容体同士が結合する(ヘテロダイマー)こともある。 制御増殖因子の結合により2つの反応が起きる:
リン酸化を受けるアミノ酸がキナーゼドメインにいくつかある場合、リン酸化されたアミノ酸が多いほどキナーゼ活性は上昇する。この場合、最初のリン酸化はシス自己リン酸化といい、これでキナーゼは「オフ」から「スタンバイ」状態に切り替わる。 非受容体型チロシンキナーゼ代表的な構造は、細胞外領域をもたず、細胞内で細胞膜に結合し、細胞内の末端側にチロシンキナーゼ部位をもつ構造である。免疫グロブリンやサイトカイン等の結合部位を持ち,これらの刺激により活性化する。
ヒスチジンキナーゼヒスチジン特異的キナーゼ(EC 2.7.13.x)は構造的に他のキナーゼと異なりGHKL型kinase/ATPase スーパーファミリーに分類される。ヒスチジンキナーゼは原核生物のほか菌類と植物に見られ、「2成分系シグナル伝達」で機能する。ATPのリン酸基はまずキナーゼ分子のヒスチジン残基(イミダゾール環窒素原子)に移され、その後他のタンパク質(同じキナーゼ分子内のばあいもある)の「レシーバードメイン」にあるアスパラギン酸残基に移される(この段階ではATPのエネルギーは必要ない)。このようなリン酸の受け渡しがさらに繰り返されるばあいもある。その結果として転写制御などが行われる。リン酸化アスパラギン酸が活性型としてシグナルを伝達する。微生物では細胞外の状態(浸透圧、酸素や栄養分など)を感知するいろいろな受容体、植物では植物ホルモン(サイトカイニン、エチレン)受容体や光受容体などが知られる。 動物にあるピルビン酸脱水素酵素キナーゼは構造的にヒスチジンキナーゼに類似しているGHKL型kinaseであるが、ヒスチジンを介した2成分系シグナル伝達は行わず、ピルビン酸脱水素酵素のセリン残基を直接リン酸化する。 アスパラギン酸/グルタミン酸キナーゼEC 2.7.12.x 脚注1. ^ Plowman GD, Sudarsanam S, Bingham J, et al. "Review. The protein kinases of Caenorhabditis elegans: a model for signal transduction in multicellular organisms." Proceedings of the National Academy of Sciences of the United States of America 1999;96:13603-13610. PMID 10570119 関連項目外部リンク
<img src="//ja.wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1x1" alt="" title="" width="1" height="1" style="border: none; position: absolute;" /> 「https://ja.wikipedia.org/w/index.php?title=プロテインキナーゼ&oldid=67323040」から取得 カテゴリ:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ヒストン脱アセチル化酵素ヒストン脱アセチル化酵素(-だつあせちるかこうそ;Histone Deacetylase(HDAC);EC 3.5.1)とはクロマチン構造において主要な構成因子であるヒストンの脱アセチル化を行う酵素である。遺伝子の転写制御において重要な役割を果たしている。ヒトでは、現在HDAC1-11,SirT1-7の18種類が同定されている。 概要遺伝子の発現は遺伝子の塩基配列によるもの以外にDNAあるいはヒストンに対する後付けの修飾により制御される場合がある(エピジェネティックな制御)。ヒストンはDNAが巻きついているコアヒストン(H2A、H2B、H3、H4)とDNAのリンカー部分に結合しているリンカーヒストン(H1)に大別される。コアヒストンのアセチル化はエピジェネティックな遺伝子の制御において重要な役割を担っている[1]。 ヒストンはそのアミノ酸配列中にリジンやアルギニンなどの塩基性アミノ酸を多く含むため通常陽性に荷電しており、陰性に荷電しているDNAとの結合が容易である。細胞内のヒストンアセチル基転移酵素(英:Histone Acetyl Transferase、HAT)により行われるヒストンアセチル化はヒストン中の特定のリジン残基のアミノ基(-NH2)をアミド(-NHCOCH3)に変換することにより電荷を中和してしまうため、結果としてヒストン-DNA間の結合を部分的に弱める。このことはヒストンに対するDNAの巻きつきが弱くなることを意味し、隣り合ったヒストン-DNA複合体(ヌクレオソーム)同士をつないでいるDNA鎖(リンカーDNA)に対して転写因子やRNAポリメラーゼがより結合しやすい状態になる。ヒストン脱アセチル化とはこのアセチル化された部位を加水分解により除去し、元のアミノ基に戻すことによりヒストンへのDNAの巻きつきを強めて転写を抑制する反応であり、ヒストンアセチル化とは逆の機構である。ヒストン脱アセチル化反応はHDACにより行われる。 ヒストンでは、N末端のリシン残基がアセチル化、脱アセチル化され、これが遺伝子発現の制御に関わっている。ヒストンが多数アセチル化されている染色体領域は、遺伝子の転写が活発に行われており、ヒストンのアセチル化は遺伝子発現を活性化させ、脱アセチル化は遺伝子の発現を抑制していると考えられている[2][3]。 ヒストンは上記で述べたアセチル化の他にもリン酸化やメチル化による制御を受ける。HDACは細胞内情報伝達(Notchシグナリング等)や細胞周期の制御にも関与している。特に近年、HDACは癌治療の標的分子として注目されている[4]。 分類HDACは配列の相同性などにより4つのクラスに分類される。
HDAC阻害薬
脚注1. ^ Miremadi A,Oestergaard MZ,Pharoah PD and Caldas C.(2007)"Cancer genetics of epigenetic genes."Hum.Mol.Genet.16 SpecNo1 R28-49. PMID 17613546 2. ^ “アーカイブされたコピー”. 2012年12月15日時点のオリジナルよりアーカイブ。2011年6月14日閲覧。 3. ^ “アーカイブされたコピー”. 2012年7月20日時点のオリジナルよりアーカイブ。2011年6月14日閲覧。 4. ^ Suzuki T and Miyata N.(2006)"Epigenetic control using natural products and synthetic molecules."Curr.Med.Chem.13,935-58. PMID 16611076 参考図書
関連項目
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
PTENPTEN(ピーテン、Phosphatase and Tensin Homolog Deleted from Chromosome 10)とはイノシトールリン脂質であるホスファチジルイノシトール3,4,5-三リン酸(PtdIns(3,4,5)P3)の脱リン酸化反応を触媒する酵素である。 PTEN遺伝子および分子の特徴PTENの構造。 PTEN遺伝子は1997年に腫瘍抑制因子として同定され[1][2]、染色体上の10q23.3に位置している。PTENタンパク質の構造中にはホスファターゼドメインとC2ドメインが含まれることがX線構造解析により明らかにされており、ホスファターゼドメインはPTENの酵素活性中心部位であり、C2ドメインは生体膜のリン脂質との結合に重要な部位である。PTENタンパク質は広く全身の細胞に発現しているが、特に上皮系の細胞に発現が高い。 機能イノシトールリン脂質であるPtdIns(3,4,5)P3はPI3キナーゼ(PI3K)により細胞内で合成され、プロテインキナーゼB(PKB)/Aktの活性化を引き起こすことにより多彩な生物活性の発現に寄与している。PTENはタンパク質に対するホスファターゼ活性は弱く、活性型のイノシトールリン脂質であるPtdIns(3,4,5)P3の脱リン酸化反応を担い、PtdIns(4,5)P2へと変換する。PTENが阻害されることにより細胞内にはPtdIns(3,4,5)P3が蓄積し、発がんに関与するシグナルが伝達される。実際、癌細胞においてはPTEN遺伝子に変異などの異常が見つかっている[3]。 マイクロRNAによる制御マイクロRNAの1種であるmiR-22はAktを活性化することでPTEN/Akt経路を制御している[4]。miR-22はがん化の抑制に働いている事が分かっているが[5]、その一つの経路としてPTEN/Akt経路が考えられる。
出典· 今堀 和友、山川 民夫 編集 『生化学辞典 第4版』東京化学同人 2007年 ISBN 978-4-8079-0670-3 · Gomperts BD, Kramer IM and Tatham PE 原著『シグナル伝達』メディカル・サイエンス・インターナショナル 2004年 ISBN 4-89592-369-X 参考文献1. ^ Steck PA, Pershouse MA, Jasser SA, Yung WK, Lin H, Ligon AH, Langford LA, Baumgard ML, Hattier T, Davis T, Frye C, Hu R, Swedlund B, Teng DH and Tavtigian SV.(1997)"Identification of a candidate tumour suppressor gene, MMAC1, at chromosome 10q23.3 that is mutated in multiple advanced cancers."Nat.Genet. 15, 356-362. PMID 9090379 2. ^ Li J, Yen C, Liaw D, Podsypanina K, Bose S, Wang SI, Puc J, Miliaresis C, Rodgers L, McCombie R, Bigner SH, Giovanella BC, Ittmann M, Tycko B, Hibshoosh H, Wigler MH, Parsons R.(1997)"PTEN, a putative protein tyrosine phosphatase gene mutated in human brain, breast, and prostate cancer."Sciece. 275,1943-7. PMID 9072974 3. ^ Li J, Yen C, Liaw D, Podsypanina K, Bose S, Wang SI, Puc J, Miliaresis C, Rodgers L, McCombie R, Bigner SH, Giovanella BC, Ittmann M, Tycko B, Hibshoosh H, Wigler MH, Parsons R.(1997)"PTEN, a putative protein tyrosine phosphatase gene mutated in human brain, breast, and prostate cancer."Science. 28,1943-7. PMID 9072974 4. ^ Bar N, Dikstein R (2010) miR-22 Forms a Regulatory Loop in PTEN/AKT Pathway and Modulates Signaling Kinetics. PLoS ONE 5(5): e10859. doi:10.1371/journal.pone.0010859 5. ^ Dan Xu, Hidetoshi Tahara et al, miR-22 represses cancer progression by inducing cellular senescence,the Journal of cell biology,April 18, 2011 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
加水分解酵素加水分解酵素(かすいぶんかいこうそ、英: hydrolase)とはEC第3群に分類される酵素で、加水分解反応を触媒する酵素である。ヒドロラーゼと呼ばれる[1]。代表的な反応はタンパク質、脂質、多糖〈炭水化物〉をアミノ酸、脂肪酸、ブドウ糖などに消化分解する生化学反応に関与する。あるいはコリンエステラーゼ、環状ヌクレオチドホスホジエステラーゼやプロテインホスファターゼのような生体内のシグナル伝達に関与するものも多い。 概略加水分解酵素は、エステル結合〈エステラーゼ〉、グリコシド結合〈グリコシダーゼ〉、エーテル結合、チオエーテル結合、ペプチド結合〈ペプチダーゼ〉などの加水分解を触媒する物の他に、アミドC-N結合、C-C結合、C-ハロゲン結合、P-ハロゲン結合およびP-N結合の一方にHを、他方にOH基をつけて切断する反応を触媒するものが存在する[2]。またATPアーゼのようにシグナル伝達や筋収縮などに関与する酵素も加水分解酵素に分類される。 EC.3.-(加水分解酵素)EC.3.1.-(エステル結合に作用)EC.3.1.1.-(カルボン酸エステル加水分解酵素)
EC.3.1.2.-(チオエステル加水分解酵素)
EC 3.1.3.-(リン酸モノエステル加水分解酵素)
EC 3.1.4.-(リン酸ジエステル加水分解酵素)
EC 3.1.5.-(三リン酸モノエステル加水分解酵素)EC 3.1.6.-(硫酸エステル加水分解酵素)
EC 3.1.7.-(二リン酸モノエステル加水分解酵素)
EC 3.1.8.-(リン酸トリエステル加水分解酵素)EC 3.1.11.-(5'-ホスホモノエステル産生エキソデオキシリボヌクレアーゼ)
EC 3.1.13.-(5'-ホスホモノエステル産生エキソリボヌクレアーゼ)
EC 3.1.14.-(3'-ホスホモノエステル産生エキソリボヌクレアーゼ)EC 3.1.15.-(リボ核酸またはデオキシリボ核酸に作用する、5'-ホスホモノエステル産生エキソヌクレアーゼ)EC 3.1.16.-(リボ核酸またはデオキシリボ核酸に作用する、3'-ホスホモノエステル産生エキソヌクレアーゼ)EC 3.1.21.-(5'-ホスホモノエステル産生エンドデオキシリボヌクレアーゼ)
EC 3.1.22.-(3'-ホスホモノエステル産生エンドデオキシリボヌクレアーゼ)
EC 3.1.23.-(欠番)- EC 3.1.21.3, EC 3.1.21.4 あるいは EC 3.1.21.5へ統合 EC 3.1.24.-(欠番)- EC 3.1.21.3, EC 3.1.21.4 あるいは EC 3.1.21.5へ統合 EC 3.1.25.-(サイト特異性を有する代替塩基特異性エンドデオキシリボヌクレアーゼ)
EC 3.1.26.-(5'-ホスホモノエステル産生エンドリボヌクレアーゼ)
EC 3.1.27.-(3'-ホスホモノエステル産生エンドリボヌクレアーゼ)
EC 3.1.30.-(リボ核酸またはデオキシリボ核酸に作用する、5'-リン酸モノエステル産生エンドリボヌクレアーゼ)EC 3.1.31.-(リボ核酸またはデオキシリボ核酸に作用する、3'-リン酸モノエステル産生エンドリボヌクレアーゼ)EC.3.2.-.(グリコシラーゼ)EC.3.2.1.-.(O-およびS-グリコシル化合物加水分解酵素)
EC 3.2.2.-(N-グリコシル化合物加水分解酵素)
EC 3.2.3.-(S-グリコシル化合物加水分解酵素) (廃止)
EC.3.3.-.(エーテル結合に作用)EC 3.3.1.-(チオエーテルおよびトリアルキルスルホニウム加水分解酵素)
EC 3.3.2.-(エーテル加水分解酵素)
EC 3.4.-.(ペプチド結合に作用(ペプチダーゼ))EC 3.4.1.-(α-アミノアシルペプチド加水分解酵素) (廃止)
EC 3.4.2.-(ペプチド性アミノ酸加水分解酵素) (廃止)
EC 3.4.3.-(ジペプチド加水分解酵素) (廃止)
EC 3.4.4.-(ペプチド性ペプチド加水分解酵素) (廃止)
EC 3.4.11.-(アミノペプチダーゼ)
EC 3.4.12.-(ペプチド性アミノ酸加水分解酵素ないしはアシルアミノ酸加水分解酵素) (廃止)
EC 3.4.13.-(ジペプチダーゼ)
EC 3.4.14.-(ジペプチジルペプチダーゼおよびトリペプチジルペプチダーゼ)
EC 3.4.15.-(ペプチジルジペプチダーゼ)
EC 3.4.16.-(セリン性カルボキシペプチダーゼ)
EC 3.4.17.-.(金属プロテアーゼ)
EC 3.4.18.-(システイン性カルボキシペプチダーゼ)EC 3.4.19.-(オメガペプチダーゼ)
EC 3.4.21.-(セリンエンドペプチダーゼ)
EC 3.4.22.-.(システインプロテアーゼ)
EC 3.4.23.-.(アスパラギン酸プロテアーゼ)
EC.3.4.24.-(金属エンドペプチダーゼ)
EC 3.4.25.-(トレオニンエンドペプチダーゼ)EC 3.4.99.-(触媒機構不明のエンドペプチダーゼ)
EC 3.5.-.(ペプチド結合以外の炭素-窒素結合に作用する)EC 3.5.1.-(鎖状アミドに作用)
EC 3.5.2.-(環状アミドに作用)
EC 3.5.3.-(鎖状アミジンに作用)
EC 3.5.4.-(環状アミジンに作用)
EC 3.5.5.-(ニトリルに作用)
EC 3.5.99.-(その他の化合物に作用)
EC 3.6.-(酸無水物に作用)EC 3.6.1.-(リン含有酸無水物に作用)
EC 3.6.2.-(スルホニル含有酸無水物に作用)EC 3.6.3.-(酸無水物に作用・物質の膜輸送を触媒する)
EC 3.6.4.-(酸無水物に作用・細胞または細胞小器官の運動に関与)
EC 3.6.5.-(GTPに作用・細胞または細胞小器官の運動に関与)
EC 3.7.-(炭素-炭素結合に作用)EC 3.7.1.-(ケトン類に作用)
EC 3.8.-(ハロゲン化物に作用)EC 3.8.1.-(C-ハロゲン化物に作用)
EC 3.8.2.-(P-ハロゲン化物に作用)
EC 3.9.-(リン-窒素結合に作用)EC 3.10.-(硫黄-窒素結合に作用)EC 3.11.-(炭素-リン結合に作用)EC 3.12.-(硫黄-硫黄結合に作用)EC 3.13.-(炭素-硫黄結合に作用)
出典1. ^ 加水分解酵素、『世界大百科事典』、CD-ROM版、平凡社 2. ^ 加水分解酵素、『理化学辞典』、第5版、岩波書店 関連項目
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ピルビン酸カルボキシラーゼ
ピルビン酸カルボキシラーゼ(Pyruvate carboxylase)は、ピルビン酸を不可逆的にカルボキシル化してオキサロ酢酸にするリガーゼ群の酵素である。 酵素反応この反応はクエン酸回路を回転させるために必要なオキサロ酢酸を供給する最も重要な炭酸固定補充反応である。この酵素はビオチンで構成されるミトコンドリアのタンパク質で、マグネシウムもしくはマンガンとアセチルCoAを必要とし、筋肉ではなく肝臓で起こる。高濃度のADPは酵素のリン酸化を抑制するため酵素の活動は維持され、その間はアセチルCoAがアロステリック効果によって酵素の活性剤となる[1]。 糖新生糖新生では最初にピルビン酸からホスホエノールピルビン酸が合成される。ピルビン酸は始めミトコンドリアでピルビン酸カルボキシラーゼによってオキサロ酢酸に変換される。その間ATPが1分子加水分解される。そのときオキサロ酢酸は、ホスホエノールピルビン酸カルボキシキナーゼによって脱炭酸とリン酸化反応が同時に触媒され、細胞質にホスホエノールピルビン酸が生成する。ミトコンドリアから細胞質へのホスホエノールピルビン酸の輸送は、リンゴ酸/ホスホエノールピルビン酸シャトルによって調停される。 脚注
関連項目 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
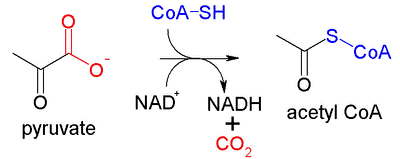
ピルビン酸デヒドロゲナーゼ複合体ピルビン酸デヒドロゲナーゼ複合体(ピルビンさんデヒドロゲナーゼふくごうたい、Pyruvate dehydrogenase complex、PDC)とは、ピルビン酸をアセチルCoAに変換(ピルビン酸脱炭酸反応と呼ばれる)する3つの酵素の複合体である。アセチルCoAはクエン酸回路に送られて細胞呼吸に使われており、この複合体は解糖系とクエン酸回路とを繋げている。また、ピルビン酸脱炭酸反応は、ピルビン酸の酸化を必要とするためピルビン酸デヒドロゲナーゼ反応としても知られる。 このマルチ酵素複合体は、オキソグルタル酸デヒドロゲナーゼ英語版(EC:1.2.4.2、2.3.1.61、1.8.1.4)と分岐鎖αケト酸デヒドロゲナーゼ複合体英語版(EC:1.2.4.4)と構造的・機能的に関係がある。これらと合わせ3つを総称しKADH(α-ketoacid dehydrogenase) complexesと呼ぶことがある。 反応ピルビン酸デヒドロゲナーゼ複合体の酵素反応; 構造と機能ピルビン酸デヒドロゲナーゼ複合体は、真核生物のミトコンドリアのマトリックスに位置する。全部で60のサブユニットを含み、3つの機能性タンパク質を組織する。
ピルビン酸デヒドロゲナーゼ(E1)
始め、ピルビン酸とチアミン二リン酸(TPP)がピルビン酸デヒドロゲナーゼサブユニットに結合する。TPPのチアゾール環は双性イオンの型をとっており、C2炭素がピルビン酸のC2(ケトン)カルボニルに求核攻撃する。結果、脱炭酸しアシルアニオン相当の生成物を与える。このアニオンはリシン残基に結合しているα-リポ酸のS1に攻撃し、SN2機構で環が開いてS2の方はスルフィドまたはチオール基に変わる。続いて、TPP補因子を放出してリポ酸のS1にチオ酢酸が結合したS-アセチルジヒドロリポイルリシンが形成する。ピルビン酸デヒドロゲナーゼ触媒機構は、ピルビン酸デヒドロゲナーゼ複合体の律速過程である。 ジヒドロリポイルトランスアセチラーゼ(E2)リポ酸チオエステルの役割は、ジヒドロリポイルトランスアセチラーゼの活性部位での置換反応である。そこでは、リポ酸の「スイングアーム」からアシル基がCoAのチオールに置換する。ここで生成したアセチルCoAは複合体から放出されてクエン酸回路に入る。 ジヒドロリポイルデヒドロゲナーゼ(E3)ジヒドロリポ酸は複合体のリシン残基に結合したままジヒドロリポイルデヒドロゲナーゼの活動部位に移動してFADによる酸化を受ける。この反応でFADは還元されてFADH2となり、その後NAD+によって酸化されてFADに戻される。結果、NADHが生成する。 関連項目
外部リンク
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ふ フィードバック阻害
フィードバック阻害(フィードバックそがい)とは、代謝系のある反応を触媒する酵素の活性が、その代謝系の生産物によって抑制される現象。生産物の生産量を調整する働きがある。アロステリック効果の一種で、生体内におけるフィードバック制御の一例でもある。生産物に類似の構造を持つ物質(アナログ)によっても起きることがあり、この場合はアナログ阻害と呼ばれる。微生物工学においては、最終生産物を大量に得るために、その生産物自身や、その生産物の前駆体、あるいはそれらのアナログによるフィードバック阻害を起こさない変異株(アナログ耐性株)を人為的に培養する手法が用いられている。 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
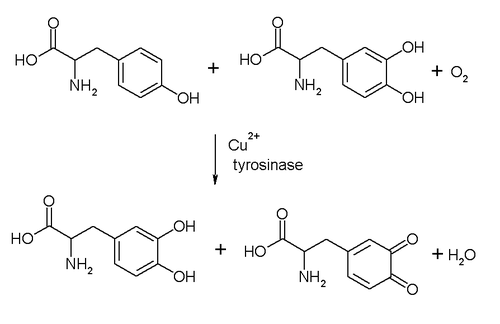
カテコールオキシダーゼ
カテコールオキシダーゼ (catechol oxidase; EC 1.10.3.1) とは、酵素の一種で、チロシナーゼ、ジフェノールオキシダーゼ、カテゴラーゼ、o-ジフェノラーゼ、フェノラーゼ等の別名を持つ。カテコールオキシダーゼは以下の反応を触媒する。 2 カテコール + O2 ⇌ {\displaystyle
\rightleftharpoons } また、チロシナーゼのような銅を含むカテコールオキシダーゼは、EC 1.14.18.1に分類されるモノフェノールモノオキシゲナーゼとしての活性も持っている。その反応のようすを以下に示す。 L-チロシン + L-ドーパ + O2 ⇌ {\displaystyle \rightleftharpoons } なお、動物由来のものはチロシン、ドーパに対する活性が高いといわれている。 参考文献· Solomon, E.I.; Chen, P.; Metz, M.; Lee, S.-K.; Palmer, A.E. (2001). “Oxygen Binding, Activation, and Reduction to Water by Copper Proteins”. Angew. Chem. Int. Ed. 40: 4570–4590. doi:10.1002/1521-3773(20011217)40:24<4570::AID-ANIE4570>3.0.CO;2-4. PMID 12404359. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ラッカーゼ
多くのラッカーゼで見られる三銅部位。銅中心にイミダゾールが結合している。 ラッカーゼ (laccase) はフェノール類を酸化する能力を持つ酸化酵素、すなわちフェノールオキシダーゼ (phenoloxidase) の一種である。ウルシなどの植物や菌類、細菌類、および動物などにみられ、中心金属は銅である。 昆虫のラッカーゼには2種類あり、ラッカーゼ1とラッカーゼ2に分かれる。ラッカーゼ2は昆虫のクチクラのタンニングと硬化において重要であり、脱皮時に働く。他のフェノールオキシダーゼとしてチロシナーゼが知られる。 チロシナーゼはモノフェノール類を酸化し、ラッカーゼはジフェノール類を酸化するとして分類されていたが、両酵素がモノフェノールもジフェノールも酸化する能力があるなど曖昧な点が多く、現在では総称としてフェノールオキシダーゼと呼ばれることが多い。 傷の修復などに関わっていると考えられているが、詳細は不明である。フェノールオキシダーゼはカテコールの酸化を促進する酵素である。 外部リンク· Laccase - MeSH、米国国立医学図書館、生命科学用語シソーラス (英語サイト) カテゴリ: |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
セルロプラスミン
セルロプラスミン (ceruloplasminまたはcaeruloplasmin)は、公式にはフェロキシダーゼ (ferroxidase) または鉄(II):酸素-オキシドリダクターゼとして知られている。 血液中に見られる銅輸送タンパクであり、酵素である。(EC 1.16.3.1)
解説欠損症セルロプラスミンが欠損している場合、その原因として挙げられるものは:
過少症・欠乏症セルロプラスミンレベルが通常より低値である場合、その原因として挙げられるものは: 過多症・過剰症セルロプラスミンレベルが通常より高値である場合、その原因として挙げられるものは: 脚注1. ^ a b c GRCh38: Ensembl release 89: ENSG00000047457 - Ensembl, May 2017 2. ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000003617 - Ensembl, May 2017 3. ^ "Human PubMed Reference:". 4. ^ "Mouse PubMed Reference:". 外部リンク関連項目<img src="//ja.wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1x1" alt="" title="" width="1" height="1" style="border: none; position: absolute;" /> 「https://ja.wikipedia.org/w/index.php?title=セルロプラスミン&oldid=65989107」から取得 カテゴリ: |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
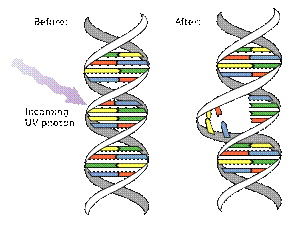
フォトリアーゼ
フォトリアーゼ(Photolyase)(EC 4.1.99.3)は、紫外線に曝露されたことによって起こるピリミジン二量体の生成によるDNA損傷を修復するDNA修復酵素である。この酵素のメカニズムとして、可視光、特に可視光スペクトルの端の紫色や青色の光を優先的に必要としており、光回復酵素として知られている。 解説
フォトリアーゼは、相補DNA鎖に結びつき同じDNA鎖上の隣り合ったチミンやシトシンの対が共有結合することによって生成するピリミジン二量体を分解する。これらの二量体はDNA構造に損傷と呼ばれる膨らみをもたらす。最も一般的な共有結合は、シクロブタン架橋を形成する。フォトリアーゼは、これらのDNA損傷に高い親和性を持ち、可逆的に結び付き、これらの損傷を元の正常な塩基に修復する。 フォトリアーゼは、フラボタンパク質であり、2つの集光補因子を含んでいる。すべてのフォトリアーゼは、2電子還元されたFADH-を含んでおり、これらのフォトリアーゼは2番目の補因子に基づいて葉酸フォトリアーゼのプテリン 5,10-メテニルテトラヒドロ葉酸とデアザフラビン(補酵素F420))フォトリアーゼのデアザフラビン(補酵素F420))8-ヒドロキシ-7,8-ジデメチル-5-デアザリボフラビン(8-HDF)の2つの主要なグループに分けることができる。FADのみが触媒作用に求められるが、2番目の補因子は低照度の環境で反応率を有意に高めている。光のエネルギーによって活性化され、ピリミジン二量体を分解する電子供与体として働く還元されたフラビンFADH-が電子を移動させることによってフォトリアーゼが機能する[1]。 フォトリアーゼは、バクテリア、菌類から動物にわたる多数の種に存在し機能している[2]。しかし、ヒトを含む有胎盤哺乳類では、フォトリアーゼに相当する酵素は遺伝子修復機能は失活しており、フォトリアーゼの類縁遺伝子(ホモログ)であるクリプトクロムのCRY1とCRY2がサーカディアンリズムの調整機能を担っている。これらの動物では、紫外線により生じた例えばチミン二量体による損傷のDNA修復は、ヌクレオチド除去修復により行われる。 系列の類似性に基づいてDNAフォトリアーゼは、2グループにまとめることができる。最初のグループは、グラム陰性菌、グラム陽性菌、好塩性古細菌、ハロバクテリウム(Halobacterium halobium)、菌類及び植物に由来するフォトリアーゼを含んでいる。このドメインのタンパク質は、青色光誘導遺伝子発現及びサーカディアンリズムの調整を仲介する青色光受容体であるシロイヌナズナのクリプトクロム1及び2(CRY1とCRY2)も含んでいる。 ある日焼け止め剤は、その成分にフォトリアーゼを含んでおり、紫外線ダメージスキンに修復作用があるとうたっている[3]。 このドメインを含むヒトのタンパク質脚注
関連項目 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
不競合阻害不競合阻害(ふきょうごうそがい、英: Uncompetitive inhibition)、不競争阻害、不拮抗阻害は、酵素阻害剤が酵素と基質との間で形成される複合体(E-S複合体)にのみ結合する時に起こる。反競合阻害(英: anti-competitive inhibition)としても知られている。 不競合阻害には酵素-基質複合体が形成される必要があるが、非競合阻害は基質が存在しても存在しなくても起こりうる。 機構このE-S複合体の有効濃度の減少は、ルシャトリエの原理によって酵素の基質に対する見かけの親和性を増加させ(Kmが低下する)、最大酵素活性 (Vmax) を低下させる。不競合阻害は基質濃度が高い時に最も良く機能する。不競合阻害剤は反応の基質と似ている必要はない。 数学的定義
ラインウィーバー=バーク式はvを開始反応速度、Kmをミカエリス・メンテン定数、Vmaxを最大反応速度、[S] を基質濃度とすると、である[1]。 不競合阻害剤に対するラインウィーバー=バークプロットは元々の酵素-基質プロットと平行だが、阻害項 上式において、[I] は阻害剤の濃度、Kiは阻害剤を特徴付ける阻害定数である[2][3]。 脚注1. ^ Cleland, W. W. (1963). “The kinetics of enzyme-catalyzed reactions with two or more substrates or products. II. Inhibition: nomenclature and theory”. Biochim. Biophys. Acta 67: 173-187. doi:10.1016/0926-6569(63)90226-8. PMID 14021668. 2. ^ Rhodes, David. “Enzyme Kinetics - Single Substrate, Uncompetitive Inhibition, Lineweaver-Burk Plot”. Purdue University. 2013年8月31日閲覧。 3. ^ Cornish-Bowden A. (1974). “A simple graphical method for determining the inhibition constants of mixed, uncompetitive and non-competitive inhibitors”. Biochem. J. 137 (1): 143-144. PMC 1166095. PMID 4206907. <img src="//ja.wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1x1" alt="" title="" width="1" height="1" style="border: none; position: absolute;" /> 「https://ja.wikipedia.org/w/index.php?title=不競合阻害&oldid=64090510」から取得 カテゴリ: |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
コリンエステラーゼ
コリンエステラーゼ(Cholinesterase。ChEと略す。)とは、コリンエステル類を加水分解する酵素である。 種類アセチルコリンエステラーゼとブチリルコリンエステラーゼの2種類が存在する。このうちブチリルコリンエステラーゼをコードしている遺伝子には、ヒトにおいて遺伝子の多型が見られ、中には、この酵素の活性が低い個体も見られる [1] 。 このために、エステル結合を持った化学物質の代謝の速度に違いが見られる場合こともある。これに対して、アセチルコリンエステラーゼをコードしている遺伝子には、2005年現在において、ヒトでの遺伝子の多型は知られていない [1] 。 恐らく、ブチリルコリンエステラーゼとは違って、もしもアセチルコリンエステラーゼに変異が存在すると致命的であるがために、アセチルコリンエステラーゼをコードしている遺伝子には多型が見られないのだろうと考えられている [1] 。 アセチルコリンエステラーゼAChEと略すことがある。また、真正コリンエステラーゼとも呼ばれる。神経組織、赤血球などに存在する。コリン作動性神経(副交感神経、運動神経、交感神経の中枢~神経節)の神経伝達物質の1種であるアセチルコリンをコリンに分解し、アセチルコリンエステラーゼ自身はアセチル化される。これに伴いアセチルコリンエステラーゼは失活するものの、数ミリ秒で脱アセチル化が起こり、再び活性を得る。なおアセチル基は酢酸となって遊離される。 ブチリルコリンエステラーゼBuChEと略すことがある。また、偽コリンエステラーゼとも呼ばれる。肝臓、血清などに存在する。AChを含む様々なコリンエステル類を分解する。健康診断などで検査されるChEは、こちらの方である。高値の場合はネフローゼ症候群、脂肪肝など、低値の場合は肝硬変、肝炎、有機リン系薬物中毒(有機リン系の農薬中毒、サリンなどの神経ガス中毒)などが疑われる。なお、ブチリルコリンエステラーゼに変異があったり、または酵素そのものが欠損している場合、例えば、スキサメトニウムによる筋弛緩が長く続くなどの影響も出てくる [2] 。 コリンエステラーゼの阻害剤「アセチルコリンエステラーゼ阻害剤」も参照 アセチルコリンによってコリンエステラーゼがアセチル化されて失活しても、数ミリ秒で脱アセチル化が起こるため、コリンエステラーゼの活性はすぐに戻る。このため、仮にアセチルコリンを投与したところで、簡単にコリンと酢酸に分解されてしまう。しかし、コリンエステラーゼがカルバモイル化されて失活した場合は、数時間程度で脱カルバモイル化が起こって、再び活性を得るという転帰をたどり、この場合はコリンエステラーゼの作用が大きく阻害される。これを利用しているのがネオスチグミンやピリドスチグミンである。これらの薬剤は自身が分解される代償に、コリンエステラーゼをカルバモイル化する。また、毒として使われるカラバルマメ英語版に含まれるフィゾスチグミンも同様である。 したがって、もしこれらの薬剤や毒で中毒症状が出た場合は、例えばアトロピンを投与するなどしてアセチルコリンの分解が滞ったことでアセチルコリンの量が過剰になった影響を除いて時間を稼ぎ、コリンエステラーゼの脱カルバモイル化が起こるのを待てば良い。この他、エドロホニウムのような、上記とは違った作用機序をもったコリンエステラーゼの可逆的な阻害剤と言われている薬剤で中毒症状が起きた時も、やはり同様にコリンエステラーゼが元に戻るまでアトロピンを投与するなどして時間を稼ぐという手が使える。これらに対して、リン酸化されて失活した場合は、脱リン酸化は非常に起こりにくいため、事実上再活性されることはない。これを利用しているのがパラチオンのような有機リン系農薬やサリンのような化学兵器である。リン酸化されたコリンエステラーゼを脱リン酸化させるためにはPAMを用いる。 歴史1968年にコロンビア大学のWalo Leuzingerらがデンキウナギから精製に成功した。 出典
関連項目] |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
プルラナーゼ
プルラナーゼ(Pullulanase、EC 3.2.1.41)は、プルランを分解するグルカナーゼの一種であり、細胞外酵素である[1][2][3]。系統名は、pullulan 6-glucanohydrolase。GH13ファミリー。 概要Bender & Wallenfels(1959)によりAerobacter aerogenes(後にKlebsiella aerogenes)から見いだされた酵素で、プルランのα-1,6グルコシド結合を加水分解し、α-マルトトリオースを生成する。この酵素が、澱粉やグリコーゲンのα-1,6グルコシド結合をも加水分解するので、澱粉糖化で注目され、種々の細菌から分類され、実用化されている[4]。 プルラナーゼは細胞の表面に固定されるリポタンパク質としてクレブシエラ属のグラム陰性菌によって生産される。またその他の細菌や古細菌も生産することがある。I型プルラナーゼはα-1,6結合を特異的に切断するのに対し、II型プルラナーゼはα-1,4結合も加水分解することができる。プルラナーゼは、穀物からエタノールや甘味料を製造する過程で用いられる。 応用プルラナーゼの逆反応を利用して、サイクロデキストリンとマルトースとの高濃度液から、効率良く分岐サイクロデキストリンを生成することができる[4]。 出典1. ^ Lee, E.Y.C. and Whelan, W.J. (1972). “Glycogen and starch debranching enzymes”. In Boyer, P.D.. The Enzymes. 5 (3rd ed.). New York: Academic Press. pp. 191–234. 2. ^ Bender, H. and Wallenfels, K. (1966). “Pullulanase (an amylopectin and glycogen debranching enzyme) from Aerobacter aerogenes”. Methods Enzymol.. Methods in Enzymology 8: 555–559. doi:10.1016/0076-6879(66)08100-X. ISBN 9780121818081. 3. ^ Manners, D.J. (1997). “Observations on the specificity and nomenclature of starch debranching enzymes”. J. Appl. Glycosci. 44: 83–85. 4. ^ a b 『澱粉の科学と技術 -澱粉研究懇談会50年の歩みと展望-』 ISBN 978-4990528706 関連項目
外部リンク
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
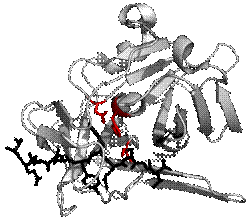
プロテアーゼTEVプロテアーゼの構造。基質とのペプチド結合を黒、触媒残基を赤で表す。(PDB 1LVB) プロテアーゼ(Protease、EC 3.4群)とはペプチド結合加水分解酵素の総称で、プロテイナーゼ(proteinase)とも呼ばれる。広義のペプチダーゼ(Peptidase)のこと。タンパク質やポリペプチドの加水分解酵素で、それらを加水分解して異化する。収斂進化により、全く異なる触媒機能を持つプロテアーゼが似たような働きを持つ。プロテアーゼは動物、植物、バクテリア、古細菌、ウイルスなどにある。ヒトでは小腸上皮細胞から分泌する。 機能アミノ酸がペプチド結合によって鎖状に連結したペプチド(一般に100残基未満、比較的分子量が小さい)やタンパク質(一般に100残基以上、比較的分子量が大きい)のペプチド結合を加水分解する酵素で、様々な種類のものが、生理的役割として、栄養吸収、タンパク質の廃棄とリサイクル、生体防御、活性の調節、などの幅広い分野で働いている。 分類プロテアーゼの分類は歴史的に様々な変遷を経ている。今日では切断位置によるエキソペプチダーゼないしはエンドペプチダーゼの分類が広く用いられる[1]。
古くはタンパク質を基質にするものを「プロテイナーゼ」、合成ペプチドを基質にするものを「ペプチダーゼ」としていたが、分類の境界が不明瞭である。現在のエンドペプチダーゼには従来プロテイナーゼに分類されていた大半の酵素が含まれ、エキソペプチダーゼには従来ペプチダーゼに分類されていたものの多くが属する。 エキソペプチダーゼのうち、基質のN末端から1残基ずつ切断する酵素をアミノペプチダーゼ、C末端側から1残基ずつ切断する酵素をカルボキシペプチダーゼと呼ぶ。 ペプチダーゼのうち、アルカリ性領域に至適pHを持つものは、洗剤補助剤として日用品に利用されるため、アルカリ(性)プロテアーゼとよばれることがある。 基質特異性プロテアーゼには切断する配列をあまり選ばない(基質特異性が低い)ものや、特定のタンパク質・ペプチドの特定の部位だけを特異的に切断するという切断する配列に対する高度な選択性を持つ(基質特異性が高い)タイプのものがある。ペプシン(pepsin)やキモトリプシン(chymotrypsin)などが前者の、ケキシン(Kexin)やフューリン(Furin)のようなプロセッシングプロテアーゼ、Xa因子のような血液凝固因子などが後者の例として典型的なものである。前述のHIVプロテアーゼはその基質特異性故にHIV治療の重要な標的となり、阻害剤による治療が大きな成果を上げている。 植物植物には、プロテアーゼを豊富に含むものがある。
菌類
細菌類脚注1. ^ a b 「プロテアーゼ」、『岩波生物学辞典』第4版、岩波書店、1996年。 関連項目外部リンク
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ロテインチロシンキナーゼ プロテインチロシンキナーゼ (Protein Tyrosine Kinase, PTK) は、タンパク質中のチロシン残基をリン酸化する酵素。プロテインキナーゼの一種。 プロテインチロシンキナーゼは細胞の分化、増殖、代謝、アポトーシスなどの多くのプロセスに関与している。これら経路の欠陥は、癌などの多くの疾患に関与している。 膜型プロテインチロシンキナーゼは、ErbBリセプターとしても知られ、多くのヒトの癌に関与している。 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
プロピオニルCoAカルボキシラーゼ
プロピオニルCoAカルボキシラーゼ(英:Propionyl-CoA carboxylase)は、プロピオニルCoAのカルボキシル化反応を触媒する。この酵素はビオチンに依存する。反応生成物は(S)-メチルマロニルCoAである。プロピオニルCoAは奇数鎖脂肪酸の最終生成物であり、大半のメチル基分岐脂肪酸の代謝物でもある。プロピオニルCoAはアセチルCoAとともにバリンの主な代謝物であり、メチオニンの代謝物であると同様にイソロイシンの代謝物でもある。プロピオニルCoAは、ブドウ糖前駆物質として大変重要である。(S)-メチルマロニルCoAは、動物には直接利用されなく、ラセマーゼの働きにより(R)-メチルマロニルCoAを生成する。(R)-メチルマロニルCoAは、数少ないビタミンB12依存酵素であるメチルマロニルCoAムターゼによりスクシニルCoAに変化する。スクシニルCoAは、クエン酸回路によりオキサロ酢酸からリンゴ酸に代謝される。細胞質にリンゴ酸が放出されてオキサロ酢酸、ホスホエノールピルビン酸やその他の糖新生中間体が生成される。
ATP + プロピオニルCoA + HCO3- <=> ADP + リン酸 + (S)-メチルマロニルCoA この酵素は、リガーゼとリアーゼに分類されている[1][2]。 アイソザイムヒトにおいては、次の2つのプロピオニルCoAカルボキシラーゼアイソザイムが存在する。
病理学プロピオニルCoAカルボキシラーゼの欠損は、プロピオン酸血症をもたらす[3][4][5]。 プロピオン酸血症は、プロピオニルCoAカルボキシラーゼの欠損により、プロピオン酸の蓄積を引き起こす。発症は生後1日目から数週であり、代謝性アシドーシス等によって引き起こされる哺乳不良、嘔吐、呼吸窮迫、痙攣等を引き起こし、生存した場合も精神遅滞と神経障害を来す。プロピオン酸血症はマルチプルカルボキシラーゼ欠損症、ビオチン欠損症、またはビオチダーゼ欠損症の一部としても捉えることができる[6]。 脚注
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ブロメライン この記事は検証可能な参考文献や出典が全く示されていないか、不十分です。 出典を追加して記事の信頼性向上にご協力ください。(2012年4月) ブロメライン(英: bromelain)は、タンパク質分解酵素の中のシステインプロテアーゼに分類される酵素。 概要 生のパイナップルの果実に含まれており、肉を柔らかくすることから、酢豚などの料理に用いられるとされるが、加熱調理後や煮て作られる缶詰の果実ではこのような効果はない[1]。キウイフルーツのアクチニジンやイチジクのフィシン、パパイヤのパパインも同様なタンパク質分解酵素(システインプロテアーゼ)である。 触媒残基はシステインとヒスチジンで、システイン残基のチオール基の硫黄原子がペプチド結合のカルボニル炭素に求核攻撃を行うことによって、タンパク質やペプチドの加水分解が始まるであろう。 Leupeptin などのペプチド系阻害剤や、システイン残基(チオール基)修飾試薬(水銀化合物など)によって阻害される。 脚注 ^ 一般に、ブロメライン酵素は60℃以上で変性し活性を失うので、加熱する料理での使用は、酸味や甘みが目的であると考えた方がよい。 関連項目 プロテアーゼ(タンパク質分解酵素) タンパク質 酵素 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
プロリルイソメラーゼ この記事は検証可能な参考文献や出典が全く示されていないか、不十分です。 出典を追加して記事の信頼性向上にご協力ください。(2010年11月) プロリルイソメラーゼ(Prolyl isomerase、またはペプチジルプロリルイソメラーゼ Peptidylprolylisomerase:略称PPIase)は異性化酵素(イソメラーゼ)の一種で、タンパク質分子中のプロリン残基のシス・トランス異性化を触媒する。EC 5.2.1.8。全ての生物に知られている。 アミノ酸間のペプチド結合は一般にトランス体がシス体に比べてはるかに安定(エネルギーの低い状態)で、この状態が自然に達成される。ところがプロリン残基ではその特異な構造(正確にはアミノ酸でなくイミノ酸)により、N側ペプチド結合がシス体としても比較的安定に存在する。タンパク質の正確なフォールディングの為にはこれらがいずれかに定まる必要がある。ただしこの結合のシス・トランス異性化に必要な活性化エネルギーは約20kcal/molと比較的高いので、この結合は自然には異性化しにくく、フォールディングにはプロリン残基の異性化が触媒される必要がある。プロリルイソメラーゼはここで働き、従ってシャペロンの一つということができる。 プロリルイソメラーゼの例としては、真核生物のシクロフィリン、FKBP、Pin1、原核生物のパルブリンなどがある。プロリルイソメラーゼは同じ種類のタンパク質に対しても活性を有し、自己フォールディングを促進する。シクロフィリンとFKBPはそれぞれある種の免疫抑制剤の標的タンパク質であり、イムノフィリンと総称される。これらは免疫系の調節で中心的な役割を果たすカルシニューリン等、シグナル伝達に関るいくつかのタンパク質複合体の活性発現に必要であるが、免疫抑制剤と複合体を形成すると逆にこれらタンパク質複合体を阻害する。ただしこの性質には、プロリルイソメラーゼ活性は直接関係しない可能性がある。 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
へ ヘインズ=ウルフプロット
生化学において、ヘインズ=ウルフプロット(英: Hanes–Woolf plot)は、初めの基質濃度 [S] と反応速度 v の比を [S] に対してプロットした酵素反応速度論のグラフ表現である。以下に示すミカエリス・メンテン式の変形に基づいている。 上式において、Kmはミカエリス・メンテン定数、Vmaxは最大反応速度である。 J・B・S・ホールデンは、この手法はバーネット・ウルフ(Barnet Woolf)によるものであると記した[1]。また、チャールズ・サミュエル・ヘインズ(Charles Samuel Hanes)もこの手法を用いたが、ヘインズはウルフについては言及も引用もしていない[2]。ヘインズはこの種の線型変換から反応速度論的パラメータを決定するために線型回帰を用いると、vではなく1/vの観測値および計算値との間で最も適合するような結果を生成するため、この手法には欠陥があると指摘した。 式はミカエリス・メンテン式から以下のように導くことができる。 逆数を取り
[S] をかけると、 変形すると、 となる。 上式から明らかなように、完璧なデータからは傾き1/Vmax、y切片Km/Vmax、x切片−Kmの直線が得られる。 ミカエリス・メンテン式を線型化するその他の手法と同様に、ヘインズ=ウルフプロットはKm、Vmax、Vmax/Kmといった重要な反応速度論的パラメータを迅速に決定するために歴史的に使用されていたが、はるかに正確である非線型回帰手法に取って代わられている。しかしながら、データをグラフを使って示す方法としては引き続き有用である。 ヘインズ=ウルフプロットの1つの欠点は、縦座標と横座標のどちらも独立変数を表わさない点である(どちらも基質濃度に依存している)。その結果、適合度の典型的な指標である相関係数Rを適用できない。 脚注1. ^ Haldane, J. B. S. (20 April 1957). “Graphical Methods in Enzyme Chemistry”. Nature 179 (832). doi:10.1038/179832b0. 2. ^ Hanes, CS (1932). “Studies on plant amylases: The effect of starch concentration upon the velocity of hydrolysis by the amylase of germinated barley.”. Biochemical Journal 26 (5): 1406–1421. PMC 1261052. PMID 16744959. 関連項目 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ペクチナーゼ ペクチナーゼ (pectinase) はペクチンを分解する触媒能を持つ酵素の総称。ポリガラクツロナーゼ、ペクチンリアーゼ、ペクチンエステラーゼ、ペクチンメチルエステラーゼなどがある。ペクチンは果汁の濁りの原因物質であるため、食品工業的には果汁を清澄化するために用いられている。こうした用途に用いる場合、主にアスペルギルス・ニガーによって工業的に生産される。 植物細胞のプロトプラスト作成において、セルラーゼと共に用いられる酵素でもある。 関連項目 凍結含浸法
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ペグロティカーゼ ペグロティカーゼ(Pegloticase)とは、難治性の痛風の治療のために用いる酵素製剤で、尿酸オキシダーゼの1種である。尿酸は、分子状の酸素と水の存在する環境において、ペグロティカーゼによって5-ヒドロキシイソ尿酸と過酸化水素に変換される。その後、5-ヒドロキシイソ尿酸は自発的にアラントインと二酸化炭素とに分解する。こうして産生するアラントインは水溶性が高く、腎臓から容易に排泄される。 解説 ペグロティカーゼは2010年9月にアメリカ合衆国でアメリカ食品医薬局が、さらに2013年1月にはヨーロッパで欧州医薬品庁が、それぞれ痛風治療薬として市販することを許可した薬剤である。基本的には他の薬剤では治療が難しい、約3 %ほどの痛風患者のために使用される場合のある薬剤である [1] 。 ペグロティカーゼは2週間おきに静脈への点滴によって投与する [1] 。 こうすることで、血中の尿酸を減らす効果が出る [2] 。 ただし、これによって痛風は改善するかもしれないけれども、ペグロティカーゼは抗原になりにくいように加工してあるとは言え [3] 、それでも抗原と成り得ることもあって [4] 、ペグロティカーゼには副作用も多い [5] 。 構造 ペグロティカーゼは、約300個のアミノ酸から成るペプチドのサブユニット4つが合わさってできる、4量体のタンパク質である。各サブユニットを構成するアミノ酸のうち、リジンの残基9個ずつがエチレングリコールによって修飾されている。なお、この修飾の仕方をペグ化と言う。ペグ化したことによって、抗原になりにくいようにしている [3] 。 出典 ^ a b FDA approves new drug for gout (2010年9月14日) ^ Sundy, JS; Baraf, HS, Yood, RA, Edwards, NL, Gutierrez-Urena, SR, Treadwell, EL, Vázquez-Mellado, J, White, WB, Lipsky, PE, Horowitz, Z, Huang, W, Maroli, AN, Waltrip RW, 2nd, Hamburger, SA, Becker, MA (Aug 17, 2011). “Efficacy and tolerability of pegloticase for the treatment of chronic gout in patients refractory to conventional treatment: two randomized controlled trials”. JAMA: the Journal of the American Medical Association 306 (7): 711–20. doi:10.1001/jama.2011.1169. PMID 21846852. ^ a b Biggers, K; Scheinfeldt, N (2008). Current Opinion in Investigational Drugs 9 (4): 422–429. ^ Abraham J. Domb, Neeraj Kumar (2 August 2011). Biodegradable Polymers in Clinical Use and Clinical Development. John Wiley & Sons. ^ Sriranganathan, MK; Vinik, O; Bombardier, C; Edwards, CJ (Oct 20, 2014). “Interventions for tophi in gout.”. The Cochrane database of systematic reviews 10: CD010069. doi:10.1002/14651858.CD010069.pub2. PMID 25330136. 関連項目 ラスブリカーゼ |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ペターゼ
ペターゼ(PETase)は、日本のごみ集積場中の細菌Ideonella sakaiensis(英語版)から2016年に発見された酵素である。PETが持つエステル結合を、カルボキシ基と水酸基とに加水分解する酵素であるため、EC番号は3.1.1.101が与えられている。PETaseはPETプラスチックを単量体テレフタル酸モノ-2-ヒドロキシエチル(MHET)分子へと分解する。MHETはこれらの細菌においてMHETaseの作用によりさらにテレフタル酸ヒドロキシエチルへと分解される。MHETaseは水中でさらにテレフタル酸とエチレングリコールへと分解する[1][2]。 PETaseによって触媒される本反応は以下の通りである(nはPET鎖中のモノマーの数)[3]。 (PET)n + H2O ⇌ (ethylene terephthalate)n-1 + MHET PETaseの既知の三次元構造は5XH3、5XH2、5XG0、5XFZ、5XFY、5YNS、5XJHである。 出典 ^ Yoshida, Shosuke; Hiraga, Kazumi; Takehana, Toshihiko; Taniguchi, Ikuo; Yamaji, Hironao; Maeda, Yasuhito; Toyohara, Kiyotsuna; Miyamoto, Kenji et al. (2016-03-11). “A bacterium that degrades and assimilates poly(ethylene terephthalate)”. Science 351 (6278): 1196–1199. doi:10.1126/science.aad6359. PMID 26965627. ^ Tanasupawat, Somboon; Takehana, Toshihiko; Yoshida, Shosuke; Hiraga, Kazumi; Oda, Kohei (August 2016). “Ideonella sakaiensis sp. nov., isolated from a microbial consortium that degrades poly(ethylene terephthalate)”. International Journal of Systematic and Evolutionary Microbiology 66 (8): 2813–2818. doi:10.1099/ijsem.0.001058. PMID 27045688. ^ “BRENDA - Information on EC 3.1.1.101 - poly(ethylene terephthalate) hydrolase”. www.brenda-enzymes.org. 2018年4月17日閲覧。 関連項目 ハチノスツヅリガ(英語版) Galleria mellonella、ポリエチレンを消化できる毛虫 アスペルギルス・ツビンゲンシス(英語版) Aspergillus tubingensis、ポリウレタンを消化できる真菌 ペスタロチオプシス・ミクロスポラ(英語版) Pestalotiopsis microspora、ポリウレタンを分解できる能力を持つ植物内生真菌 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
β-ラクタマーゼ β-ラクタマーゼ(ベータラクタマーゼ、β-lactamase)とはβ‐ラクタム系抗生物質を加水分解する酵素である。ペニシリン/セファロスポリンアミド-β-ラクタムヒドロラーゼ (penicillin/cepharosporin amido-β-lactam hydrolase)とも呼ばれる。EC3.5.2.6に分類される酵素である。 幾つかの種類のグラム陰性菌がβ-ラクタマーゼを産生することでβ-ラクタムに対して耐性を示すことが知られている。なお、β-ラクタム耐性はβ-ラクタマーゼのみが原因ではなくMRSAのようにペニシリン結合タンパク質の基質特異性が変化しても現れる。 現在β-ラクタマーゼは基質特異性の違いにより ペニシリナーゼ (クラスA β-ラクタマーゼ) メタロ-β-ラクタマーゼ (クラスB β-ラクタマーゼ、亜鉛-β-ラクタマーゼ、カルバペネマーゼ) セファロスポリナーゼ (クラスC β-ラクタマーゼ) オキサシリナーゼ (クラスD β-ラクタマーゼ) が存在する[1][2][3][4]。 これら4種のβ-ラクタマーゼのうち、クラスB β-ラクタマーゼは活性中心に亜鉛を持つが、他はセリン残基を持つ。ペニシリナーゼはペニシリン系抗生物質と第二世代セファロスポリンを分解するのに対して、セファロスポリナーゼは主にセファロスポリンを分解する。オキサシリナーゼはオキサシリンをも分解するペニシリナーゼであり、メタロ-β-ラクタマーゼはカルバペネム系抗生物質を分解する点に特徴がある。 β-ラクタマーゼの遺伝子は、細菌の染色体上あるいはプラスミド上に存在する。特に伝達性薬剤耐性プラスミド (drug resistance plasmid)に存在するβ-ラクタマーゼ遺伝子は菌種特異性も少なく多剤耐性菌の発生にも関与していると考えられる。 脚注 ^ β-ラクタム耐性菌とその検出方法、関東化学 ^ Bush, K. et. al. A functional classification scheme for β-lactamases and its correlation with molecular structure, Antimicrob Agents Chemother., 39, 1211-1233, 1995. ^ Ambler, R. P., The structure of β-lactameses, Philos Trans R Society Lond (Biol), 289, 321-331, 1980. ^ 石井良和、基質特異性拡張型β-ラクタマーゼ産生大腸菌、クレブシエラ、臨床と微生物、26、121-125, 1999. 関連項目
出典 β-ラクタマーゼ『生物学辞典』第4版、岩波書店。 β-ラクタマーゼについて 日本ベクトン・ディッキンソン株式会社 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
β-ラクタマーゼβ-ラクタマーゼ(ベータラクタマーゼ、β-lactamase)とはβ‐ラクタム系抗生物質を加水分解する酵素である。ペニシリン/セファロスポリンアミド-β-ラクタムヒドロラーゼ (penicillin/cepharosporin amido-β-lactam hydrolase)とも呼ばれる。EC3.5.2.6に分類される酵素である。 幾つかの種類のグラム陰性菌がβ-ラクタマーゼを産生することでβ-ラクタムに対して耐性を示すことが知られている。なお、β-ラクタム耐性はβ-ラクタマーゼのみが原因ではなくMRSAのようにペニシリン結合タンパク質の基質特異性が変化しても現れる。 現在β-ラクタマーゼは基質特異性の違いにより · ペニシリナーゼ (クラスA β-ラクタマーゼ) · メタロ-β-ラクタマーゼ (クラスB β-ラクタマーゼ、亜鉛-β-ラクタマーゼ、カルバペネマーゼ) · セファロスポリナーゼ (クラスC β-ラクタマーゼ) · オキサシリナーゼ (クラスD β-ラクタマーゼ) これら4種のβ-ラクタマーゼのうち、クラスB β-ラクタマーゼは活性中心に亜鉛を持つが、他はセリン残基を持つ。ペニシリナーゼはペニシリン系抗生物質と第二世代セファロスポリンを分解するのに対して、セファロスポリナーゼは主にセファロスポリンを分解する。オキサシリナーゼはオキサシリンをも分解するペニシリナーゼであり、メタロ-β-ラクタマーゼはカルバペネム系抗生物質を分解する点に特徴がある。 β-ラクタマーゼの遺伝子は、細菌の染色体上あるいはプラスミド上に存在する。特に伝達性薬剤耐性プラスミド (drug resistance plasmid)に存在するβ-ラクタマーゼ遺伝子は菌種特異性も少なく多剤耐性菌の発生にも関与していると考えられる。 脚注1. ^ β-ラクタム耐性菌とその検出方法、関東化学 2. ^ Bush, K. et. al. A functional classification scheme for β-lactamases and its correlation with molecular structure, Antimicrob Agents Chemother., 39, 1211-1233, 1995. 3. ^ Ambler, R. P., The structure of β-lactameses, Philos Trans R Society Lond (Biol), 289, 321-331, 1980. 4. ^ 石井良和、基質特異性拡張型β-ラクタマーゼ産生大腸菌、クレブシエラ、臨床と微生物、26、121-125, 1999. 関連項目
出典· β-ラクタマーゼ『生物学辞典』第4版、岩波書店。 · β-ラクタマーゼについて 日本ベクトン・ディッキンソン株式会社 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ペニシリン結合タンパク質 ペニシリン結合タンパク質(ペニシリンけつごうたんぱくしつ、英: penicillin-binding protein; PBP)とは、細菌の産生する酵素群でβラクタム系抗生物質と結合すると酵素機能が阻害されるタンパク質である。 ペニシリン結合タンパク質(以下PBPと略す)は真正細菌の細胞質膜に存在する酵素群で細胞壁のペプチドグリカン合成の最終段階に作用する。大腸菌では7種類のPBPが存在する。4種類の高分子量(6万~9万)PBPはトランスグリコシラーゼとトランスペプチダーゼの二つの酵素活性を持ち細胞の伸長や隔壁形成に作用する。3種類の低分子量(4万~5万)PBPはD-アラニンカルボキシペプチダーゼ活性を持つ。 高分子量PBPのトランスペプチダーゼ活性中心ならびに低分子量PBPのD-アラニンカルボキシペプチダーゼ活性中心はいずれもセリン残基を持ち、βラクタム系抗生物質はペニシリンもセファロスポリンもこのセリン残基に結合することで酵素阻害作用を発現する。 耐性菌の発生はいろいろな機序で発生するがPBPの基質特異性が変化してβラクタム系抗生物質との結合能が低下することで発生する場合もある。 関連項目
出典 ペニシリン結合蛋白質『生化学辞典』第4版、岩波書店。 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
β-ラクタマーゼβ-ラクタマーゼ(ベータラクタマーゼ、β-lactamase)とはβ‐ラクタム系抗生物質を加水分解する酵素である。ペニシリン/セファロスポリンアミド-β-ラクタムヒドロラーゼ (penicillin/cepharosporin amido-β-lactam hydrolase)とも呼ばれる。EC3.5.2.6に分類される酵素である。 幾つかの種類のグラム陰性菌がβ-ラクタマーゼを産生することでβ-ラクタムに対して耐性を示すことが知られている。なお、β-ラクタム耐性はβ-ラクタマーゼのみが原因ではなくMRSAのようにペニシリン結合タンパク質の基質特異性が変化しても現れる。 現在β-ラクタマーゼは基質特異性の違いにより · ペニシリナーゼ (クラスA β-ラクタマーゼ) · メタロ-β-ラクタマーゼ (クラスB β-ラクタマーゼ、亜鉛-β-ラクタマーゼ、カルバペネマーゼ) · セファロスポリナーゼ (クラスC β-ラクタマーゼ) · オキサシリナーゼ (クラスD β-ラクタマーゼ) これら4種のβ-ラクタマーゼのうち、クラスB β-ラクタマーゼは活性中心に亜鉛を持つが、他はセリン残基を持つ。ペニシリナーゼはペニシリン系抗生物質と第二世代セファロスポリンを分解するのに対して、セファロスポリナーゼは主にセファロスポリンを分解する。オキサシリナーゼはオキサシリンをも分解するペニシリナーゼであり、メタロ-β-ラクタマーゼはカルバペネム系抗生物質を分解する点に特徴がある。 β-ラクタマーゼの遺伝子は、細菌の染色体上あるいはプラスミド上に存在する。特に伝達性薬剤耐性プラスミド (drug resistance plasmid)に存在するβ-ラクタマーゼ遺伝子は菌種特異性も少なく多剤耐性菌の発生にも関与していると考えられる。 脚注1. ^ β-ラクタム耐性菌とその検出方法、関東化学 2. ^ Bush, K. et. al. A functional classification scheme for β-lactamases and its correlation with molecular structure, Antimicrob Agents Chemother., 39, 1211-1233, 1995. 3. ^ Ambler, R. P., The structure of β-lactameses, Philos Trans R Society Lond (Biol), 289, 321-331, 1980. 4. ^ 石井良和、基質特異性拡張型β-ラクタマーゼ産生大腸菌、クレブシエラ、臨床と微生物、26、121-125, 1999. 関連項目
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
セルラーゼセルラーゼ (Cellulase) とは、β-1,4-グルカン(例えば、セルロース)のグリコシド結合を加水分解する酵素。主に細菌や植物において作られ、生物界に広く存在する。 分子内部から切断するエンドグルカナーゼ EC 3.2.1.4 と、糖鎖の還元末端と非還元末端のいずれから分解し、セロビオースを遊離するエキソグルカナーゼ(セロビオヒドロラーゼ) EC 3.2.1.91 にわけられる。また酵素タンパク質の構造から、ファミリーに分けられている。 保有生物菌類など生産能を有している生物のほか、哺乳類では体内に生産能を持つ別の生物を共生させているものがある。 動物類貝類 動物では巻き貝や二枚貝がセルラーゼ、ヘミセルラーゼを産生できる。 節足動物門 シロアリやゴキブリはセルラーゼを産生する単細胞の原生生物を腸内に共生させている。動物自身はセルラーゼを産生できないためこのような共生をおこなっていると考えられてきたが、シロアリの研究では、シロアリ自身のゲノムにセルラーゼをコードする遺伝子が存在し、この遺伝子が共生するバクテリアや原生生物から近年に水平転移したものでは無いことが示唆されている (Watanabe et al. 1998)。マツノザイセンチュウもセルラーゼ遺伝子の発現が認められるという報告がある。 深海底に生息するカイコウオオソコエビでは、高いグルコース(ブドウ糖)生産性を有している。 哺乳類 ウシやヒツジなどの反芻動物やウマなどの草食動物は消化管にセルラーゼを産生する微生物(細菌、糸状菌、原生生物)を生息させており、これらによるセルロース分解によって植物繊維の消化を可能にしている。 菌類[編集]子嚢菌類、担子菌類にはセルロース分解能を持つものが多い。木材の分解はこれらが主体となっており、木材腐朽菌と言われる。糸状菌トリコデルマの1種 Trichoderma reesei はセルラーゼ高生産菌として有名な菌である。50~60 g/lのタンパク質を分泌し、その大部分がセルラーゼ、ヘミセルラーゼを占めている。少なくとも5種のエンドグルカナーゼと2種類のセロビオハイドロラーゼといった複数のセルラーゼを生産することが分かっており、セルロース分解において期待されている。 好熱嫌気性セルロース分解細菌 Clostridium thermocellum では複数のサブユニットからなるセルラーゼ複合体 — セルロソーム (Cellulosome) を形成していることが知られており、これが高いセルロース分解能につながっていると考えられている。 応用植物細胞の細胞壁のみを分解し、植物細胞のプロトプラスト化する場合や、繊維の間の汚れを取るために市販の洗剤に配合されたり、ジーンズ繊維の材質の改善などに使われている。また、カイコウオオソコエビ由来のセルラーゼは廃材などのセルロースを常温でグルコース(ブドウ糖)に変換できることから、穀物を原料としないアルコール燃料の生産に寄与することが期待されている[1]。 関連項目参考文献 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ほ 補因子
生化学の分野において、補因子(ほいんし cofactor)は、酵素の触媒活性に必要なタンパク質以外の化学物質である。[1] 補因子は「補助分子、またはイオン」であると考えられ、生化学的な変化を助けている。ただし、水や豊富に存在するイオンなどは補因子とはみなされない。それは、普遍的に存在し制限されることが滅多にないためである。この語句を無機分子に限って用いている資料もある[2][3]。 補因子は2つのグループに大別できる。1つは補酵素(ほこうそ、coenzyme)で、タンパク質以外の有機分子であり、官能基を酵素間で輸送する。これらの分子は酵素とゆるく結合し、酵素反応の通常の段階では解離される。一方、補欠分子族(ほけつぶんしぞく、prosthetic group)はタンパク質の一部を構成しており、常時結合しているものである。 アポ酵素とホロ酵素
補因子を伴わない酵素はアポ酵素と呼ばれ、一方補因子を伴った完全な活性を持つ酵素をホロ酵素と呼ぶ。 金属イオン補因子詳細は「金属タンパク質」を参照 金属イオンは一般に補因子である。これらの補因子の研究は生物無機化学の領域に入る。栄養学における、必須な微量元素の補因子としての機能を下の表に示す。ヒトでは一般に鉄、マンガン、コバルト、銅、亜鉛、セレン、そしてモリブデンがこの表に含まれる[4]。クロムの欠乏はグルコースの耐糖能異常の原因となるが、クロムを補因子とする酵素はヒトでは特定されていない[5][6]。また、ヨウ素も必須な微量元素であるが、この元素は補因子よりは甲状腺ホルモンの一部として多く使われる[7]。カルシウムはヒトにとって必須な要素であり、多くの酵素(例えば、一酸化窒素合成酵素、ホスファターゼ、アデニル酸キナーゼ)の活性に必要であるが、カルシウムは他の金属イオンと違いアロステリック効果によって酵素を活性化し、そのときしばしばカルモジュリンと共にそれらの酵素と結合する[8]。したがって、カルシウムは細胞シグナリング分子であり、通常は補因子としては考えない[9]。 加えて、他の有機体では、Azotobacterのような窒素固定を行うバクテリアのニトロゲナーゼのバナジウム[10]、Pyrococcus furiosusのような好熱性古細菌のアルデヒドフェレドキシンオキシドレダクターゼのタングステン[11]、そしてタラシオシラ・ワイスフロッギーのような海洋性珪藻類の炭酸脱水酵素のカドミウム[12][13] などがある。 多くの場合、補因子は無機と有機の両方の要素を含む。その例に、鉄がポルフィリン環に包まれたヘムタンパク質がある。
補因子と酵素補因子はホスト酵素への結合の強さおよび位置が異なる。酵素に固く結合したとき、補因子は補欠分子族と呼ばれる。一方、緩く結合した補因子は基質と同じように結びつく。これらは補酵素と表現され、基質として酵素反応に直接参加する有機物質である。ビタミンは補酵素の前駆体(例:ビタミンB1, B2, B6, B12, ナイアシン, 葉酸)または補酵素自体(例:ビタミンC)を供給する。 非酵素補因子この用語は、タンパク質を活性化または抑制する非タンパク質分子に言及するために生物学の他の領域で使われる。例えば、受容タンパク質と結合して活性化させるホルモンのようなリガンドは補因子または活性化補助因子(コアクチベーター)と呼び、受容タンパク質を抑制する分子は抑制補体(コリプレッサー)と呼ぶ。 脚注
関連項目外部リンク
<img src="//ja.wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1x1" alt="" title="" width="1" height="1" style="border: none; position: absolute;" /> 「https://ja.wikipedia.org/w/index.php?title=補因子&oldid=49920669」から取得 カテゴリ: |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
補欠分子族補欠分子族(ほけつぶんしぞく、Prosthetic group)は、タンパク質の生物活性において重要なタンパク質に結合する非タンパク質(非アミノ酸)要素である[1]。補欠分子族は有機物(ビタミン、糖、脂質など)または無機物(金属イオンなど)であることがあり得る。補欠分子族はタンパク質にかたく繋がれており、共有結合を通して結合される。補欠分子族は酵素反応において重要な役割を持つ。補欠分子族が無いタンパク質はアポタンパク質と呼ばれるのに対し、補欠分子族がついているそれはホロタンパク質と呼ぶ。 補欠分子族は補因子の1つで、一時的に酵素と結合するのではなく永久的に酵素と結合しているという点で補酵素とは異なる[2]。酵素では、補欠分子族はいくつかの経路においてその活性部位に関係している。 ヘモグロビンのヘムは補欠分子族の一つである。さらに、有機物の補欠分子族にはチアミン(ビタミンB1)、チアミンピロリン酸、ピリドキサールリン酸そしてビオチンなどのビタミン誘導体がある。よって、補欠分子族はしばしばビタミンであるか、ビタミンから作られる。これが、ビタミンがヒトの食事に必要な理由の一つである。 無機物の補欠分子族は通常は鉄(チトクロムcオキシダーゼ、ヘモグロビンなどのヘム)、亜鉛(炭酸脱水酵素など)、マグネシウム(いくつかのキナーゼなど)、モリブデン(硝酸還元酵素など)のような遷移金属イオンである。 補欠分子族の一覧
脚注
関連項目外部リンク
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ホスファターゼ ホスファターゼ(Phosphatase;EC 3.1.3)とは、リン酸モノエステル加水分解酵素(ホスホモノエステラーゼ)のこと。リン酸モノエステルまたはポリリン酸化合物を加水分解し、リン酸と、水酸基を持つ化合物とに変換する脱リン酸化酵素である。ホスホリラーゼあるいはキナーゼによって行われるリン酸化の逆の効果を果たす。なお広義に、リン酸ジエステル加水分解酵素(ホスホジエステラーゼ)を含めることもある。 ホスファターゼは基質特異性の低いタイプと高いタイプに分けられる。前者にはアルカリホスファターゼや酸性ホスファターゼがあり、p-ニトロフェニルリン酸などの発色基質により活性を測定することができる。後者にはグルコース-1-ホスファターゼやタンパク質ホスファターゼなどがある。 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ホスホジエステラーゼ ホスホジエステラーゼ (Phosphodiesterase, PDE) とは、広義にはリン酸ジエステル結合(1分子のリン酸が2個の水酸基と結合した構造)の一方の結合を加水分解する酵素である。 これにはホスホリパーゼC・Dのようなリン脂質を分解するものや、核酸を分解するヌクレアーゼなども含まれる。 しかし一般には、cAMPやcGMPの環状リン酸ジエステルを加水分解する酵素(環状ヌクレオチドホスホジエステラーゼ)を特にホスホジエステラーゼと呼ぶ。 cAMPやcGMPはセカンドメッセンジャーであり、PDEはその酵素活性のバランスによってその濃度を調節し、シグナル伝達に重要な役割を担っている。 哺乳類においてPDEのスーパーファミリーは11種類あり、基質特異性などが異なる。 関連項目
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
1-(5-ホスホリボシル)-5-((5-ホスホリボシルアミノ)メチリデンアミノ)イミダゾール-4-カルボキサミドイソメラーゼ 1-(5-ホスホリボシル)-5-[(5-ホスホリボシルアミノ)メチリデンアミノ]イミダゾール-4-カルボキサミドイソメラーゼ(1-(5-phosphoribosyl)-5-[(5-phosphoribosylamino)methylideneamino]imidazole-4-carboxamide isomerase、EC 5.3.1.16)は、次の反応を触媒する酵素である。 1-(5-ホスホリボシル)-5-[(5-ホスホリボシルアミノ)メチリデンアミノ]イミダゾール-4-カルボキサミド ⇌ {\displaystyle \rightleftharpoons } 5-[(5-ホスホ-1-デオキシリブロース-1-イルアミノ)メチリデンアミノ]-1-(5-ホスホリボシル)イミダゾール-4-カルボキサミド
関連項目 異性化酵素 参考文献 IUBMB entry for 5.3.1.16(英語) BRENDA references for 5.3.1.16 (英語) PubMed references for 5.3.1.16(英語) PubMed Central references for 5.3.1.16(英語) Google Scholar references for 5.3.1.16(英語) 外部リンク IUBMB entry for 5.3.1.16(英語) KEGG entry for 5.3.1.16(英語) BRENDA entry for 5.3.1.16(英語) NiceZyme view of 5.3.1.16(英語) EC2PDB: PDB structures for 5.3.1.16(英語) PRIAM entry for 5.3.1.16(英語) PUMA2 entry for 5.3.1.16(英語) IntEnz: Integrated Enzyme entry for 5.3.1.16(英語) MetaCyc entry for 5.3.1.16(英語) Atomic-resolution structures of enzymes belonging to this class(英語) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ポリメラーゼ ポリメラーゼ(英語:Polymerase)とは、DNAやRNAのような核酸ポリマーや長鎖を合成する酵素の事である。 酵素を分類整理しているEC番号では、EC 2.7.7.6/7/19/48/49という番号が割り当てられている。 DNAポリメラーゼやRNAポリメラーゼは、塩基対形成相互作用によって、DNAまたはRNAのテンプレート鎖を複製し、それぞれDNAおよびRNA分子を組み立てるために使用される。 関連項目 Taqポリメラーゼ ポリメラーゼ連鎖反応 Terminal deoxynucleotidyl transferase 逆転写酵素 転写 (生物学) DNA修復 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
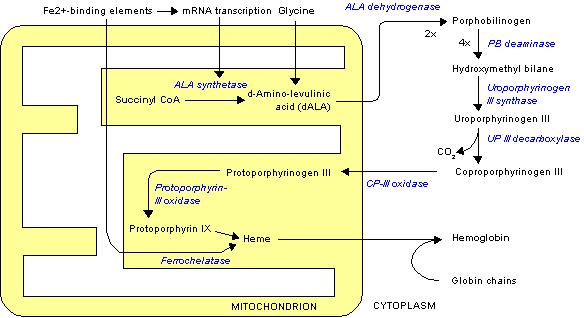
ポルフォビリノーゲンデアミナーゼ
ポルフォビリノーゲンデアミナーゼ(Porphobilinogen deaminase)(ヒドロキシメチルビランシンターゼやウロポルフィリノーゲンIシンターゼとしても知られている。)は、ポルフォビリノーゲンからヒドロキシメチルビランを合成するポルフィリン合成の第3段階で働く酵素である。この酵素は、唯一の二ピロールメタン補助因子である。この酵素の活動欠損は、急性間欠性ポルフィリン症を引き起こす。 この遺伝子は、ヒドロキシメチルビランシンターゼの一群を記述している。記述されたタンパク質は、ヘム合成回路の3段階目の酵素であり、4つのポルフォビリノーゲン縮合してを直線状のヒドロキシメチルビランを生成する作用を行う。この遺伝子の変異は、常染色体優性疾患である急性間欠性ポルフィリン症を引き起こす[5]。 4 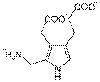
+ H2 O ⇒ 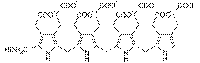
+ 4 NH3 ポルフォビリノーゲン ヒドロキシメチルビラン
ヘム合成は、細胞質やミトコンドリア内(黄色部分)で反応が起こる。 脚注1. ^ a b c GRCh38: Ensembl release 89: ENSG00000256269、ENSG00000281702 - Ensembl, May 2017 2. ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000032126 - Ensembl, May 2017 3. ^ "Human PubMed Reference:". 4. ^ "Mouse PubMed Reference:". 5. ^ “Entrez Gene: HMBS hydroxymethylbilane synthase”. 2010年7月7日閲覧。 出典http://en.wikipedia.org/wiki/Porphobilinogen_deaminase 関連事項<img src="//ja.wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1x1" alt="" title="" width="1" height="1" style="border: none; position: absolute;" /> 「https://ja.wikipedia.org/w/index.php?title=ポルフォビリノーゲンデアミナーゼ&oldid=66250898」から取得 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ホルムイミノトランスフェラーゼシクロデアミナーゼ
ホルムイミノトランスフェラーゼシクロデアミナーゼ(Formiminotransferase cyclodeaminase)は、5-ホルムイミノテトラヒドロ葉酸を5,10-メテニルテトラヒドロ葉酸とアンモニアに変換する酵素である。 関連項目 グルタミン酸-1-セミアルデヒド 外部リンク formiminotetrahydrofolate cyclodeaminase - MeSH、米国国立医学図書館、生命科学用語シソーラス (英語サイト) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ホロ酵素 ホロ酵素(ホロこうそ、英: holoenzyme)とは、酵素本体となるタンパク質分子に、非タンパク質性の分子が結合して初めて酵素として機能するものを呼ぶ。この場合の非タンパク質性の分子の部分を補因子と呼ぶ。補酵素を要求する酵素はホロ酵素であり、補酵素部分が補因子となっている。 多くの場合、非タンパク質性の部分を失うと活性を失う。このタンパク質部分のみの状態のものをアポ酵素と呼ぶ。 また、複数のタンパク質分子が複合体を形成して初めて活性を示すような酵素についても、ホロ酵素と呼ぶ場合がある。この場合、一部のサブユニットを失って活性を失った状態のものがアポ酵素と呼ばれる。 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||